-
摘要:目的 探讨不同培养基对大鼠骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)生长的影响,筛选对大鼠BMSCs生长较适宜的培养基。方法 采用全骨髓差速贴壁分离法从SD大鼠股骨和胫骨分离BMSCs,分别选用DMEM-LG、α-MEM、DMEM/F12三种培养基分离培养大鼠BMSCs。倒置相差显微镜下观察不同培养基对大鼠BMSCs形态均一化程度、克隆形成时间与第14天克隆形成数量、第1次传代时间、细胞增殖率以及细胞贴壁率等的影响;流式细胞术鉴定并观察不同培养基对大鼠BMSCs表面抗原表达的影响。结果 与其他两组相比,体外DMEM-LG培养基培养的大鼠BMSCs形态均一、克隆形成时间和第1次传代时间短、克隆形成数量多达(14±2)个、细胞贴壁率高达(47.0±2.8)%;同时,BMSCs进入对数生长期仅需4 d,且平均增殖率最高,单位时间内平均扩增数量最多,3 d总扩增数量达(2.2~2.7)×105 mL-1;采用DMEM-LG、α-MEM、DMEM/F12三种培养基分离培养的细胞均为大鼠BMSCs,且不同培养基对大鼠BMSCs表面抗原表达无明显影响。结论 DMEM-LG培养基较适合大鼠BMSCs的生长。
-
关键词:
- 大鼠骨髓间充质干细胞 /
- 原代培养 /
- 培养基筛选
Abstract:Objective To investigate the effect of three different cell culture mediums, DMEM-LG, α-MEM and DMEM/F12, on the growth of rat bone marrow mesenchymal stem cells (BMSCs) in vitro, and so that to screen out the most suitable medium for in vitro culturing the rat BMSCs.Methods BMSCS were isolated from the femur and tibia of SD rats by whole bone marrow differential adherence method. The isolated cells were then cultured with three culture mediums, DMEM-LG, α-MEM and DMEM/F12. The rat BMSCs morphology, adhesion, proliferation, the time of passage and the number the colony at day 14 in three mediums respectively were observed with inverted phase contrast microscopy and compared. Flow cytometry was used to identify and observe the effects of different mediums on the surface antigen expression of rats BMSCs.Results Compared with the other two groups of media, BMSCs cultured in DMEM-LG had shorter colony formation time, shorter first passage time, more clone formation (14±2) and showed uniform morphology and the highest attachment efficiency (47.0±2.8)%. Meanwhile, BMSCs cultured with DMEM-LG entered logarithmic growth phase after only 4 days of culturing and showed the highest average specific growth rate and the largest average number of propagations per unit time. The total number of cells reached about (2.2-2.7)×105 mL-1 within three days. The cells cultured with 3 mediums were all identified as rat BMSCs, and the expression of surface antigen in BMSCs was not significantly affected by different media.Conclusion DMEM-LG is more suitable for proliferation of rat BMSCs in vitro.-
Keywords:
- Rat BMSCs /
- Primary culture /
- Screening of the medium
-
骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)是一类具有多向分化潜能的成体干细胞,常被用作组织工程种子细胞[1-2]。但由于其在机体内的数量极少,不能满足临床组织工程的需要。因此,如何建立高效快捷的体外大规模扩增技术已成为BMSCs应用中需要解决的重要问题。BMSCs体外扩增受到诸多因素的影响,其中最直接也是最重要的影响因素就是细胞所处的细胞外环境——培养基。培养基是细胞最直接的生存环境,不同的培养基成分组成存在差异,对细胞的生长分化能力存在一定影响。目前,用于大鼠BMSCs体外培养的培养基并不统一,主要有DMEM-LG、α-MEM、DMEM/F12。但关于不同培养基对大鼠BMSCs生长及形态影响的文献报道较少。本研究旨在探讨DMEM-LG、α-MEM、DMEM/F12三种不同培养基对大鼠BMSCs体外培养的影响,为满足临床和组织工程对BMSCs的需要提供实验数据。
1. 材料和方法
1.1 材料
1.1.1 实验动物
1月龄SPF级SD大鼠(雌雄不限),由四川大学实验动物中心提供。
1.1.2 主要试剂
胎牛血清(FBS)、DMEM-LG、α-MEM、DMEM/F12培养基干粉购自HyClone公司,噻唑蓝(MTT)购自MCE公司,青霉素、链霉素购自索来宝公司,抗IgG、CD11b、CD45、CD90、CD29抗体购自BioLegend公司。完全培养基:分别在DMEM-LG、α-MEM和DMEM/F基础培养基中加15% FBS+100 U/mL青霉素+100 μg/mL链霉素,制备成DMEM-LG完全培养基、α-MEM完全培养基和DMEM/F完全培养基。
1.1.3 实验仪器
酶标分析仪(Thermo Fisher Scientific),CO2培养箱(SANYO),低温离心机(Thermo Fisher Scientific),纯水仪(Milipore),倒置显微镜(OLYMPUS),血球计数板(上海求精),流式细胞仪(Thermo Fisher Scientific)。
1.2 方法
1.2.1 大鼠BMSCs的分离培养
采用颈椎脱臼法处死大鼠,无菌条件下分离股骨、胫骨,刮除肌肉、筋膜和骨膜,切除两端骨骺。用针筒吸取10 mL无血清培养液冲出骨髓,吹散细胞,2 000 r /min,离心10 min,用相应的完全培养基分别收集细胞,以2×106 mL-1的密度接种4 mL细胞悬液于25 cm2的培养瓶,置于37 ℃、体积分数5% CO2、饱和湿度的CO2孵箱,3 h后首次换液,以后每8 h换1次液。72 h后,每3~4 d换1次液,待原代细胞生长至65%~70%融合状态,用2.5 mg/mL胰蛋白酶消化传代。此后待细胞生长至80%~90%融合状态传代。
用DMEM-LG、α-MEM、DMEM/F12三种完全培养基分别培养大鼠BMSCs,在倒置显微镜下观察细胞在第一代(P1)、第三代(P3)和第五代(P5)的形态。
1.2.2 不同培养基对大鼠BMSCs克隆形成的影响
分别用DMEM-LG、α-MEM、DMEM/F12三种完全培养基分离培养原代大鼠BMSCs,在倒置显微镜下观察细胞克隆形成的时间和数量。
1.2.3 不同培养基对大鼠BMSCs第一次传代时间的影响
分别用DMEM-LG、α-MEM、DMEM/F12三种完全培养基分离培养原代大鼠BMSCs,观察BMSCs达到第一次传代条件所需(即达65%~70%融合状态)的时间。
1.2.4 不同培养基对大鼠BMSCs增殖的影响
分别取用DMEM-LG、α-MEM、DMEM/F12三种完全培养基分离培养的P3代生长良好的BMSCs,2.5 mg/mL胰蛋白酶消化后,以6×103 mL-1接种于96孔板,每孔200 μL,每天用MTT法测定细胞增殖情况,连续9 d,以培养时间为横坐标,以光密度(OD)值为纵坐标,绘制细胞生长曲线。另取一批细胞,以3×104 mL-1接种于12孔板,每种培养基3孔,72 h取样,用血球计数板计数细胞数量,计算P3代BMSCs扩增倍数。
扩增倍数=n代收获的细胞数/n代接种的细胞数
1.2.5 不同培养基对大鼠BMSCs贴壁的影响
分别取用DMEM-LG、α-MEM、DMEM/F12三种完全培养基分离培养的P3代BMSCs (在细胞培养瓶中长至70%~80%的融合状态),用2.5 mg/mL胰蛋白酶消化,以1×105 mL-1浓度接种于6孔板中, 每孔2 mL,置于37 ℃、饱和湿度的CO2培养箱中;2 h后,用2.5 mg/mL胰蛋白酶消化细胞并计算贴壁率〔贴壁率(%)=贴壁细胞数/接种细胞数×100%〕,并以时间为横坐标,以贴壁率为纵坐标绘制贴壁率曲线。
1.2.6 大鼠BMSCs的表面抗原鉴定
分别取用DMEM-LG、α-MEM、DMEM/F12三种完全培养基分离培养的P3代BMSCs,用2.5 mg/mL胰酶消化,收集所有细胞,每管细胞数量≥5×105个,用常温PBS洗涤2次,分别加入IgG、CD11b、CD45、CD90、CD29抗体孵育30 min,常温PBS洗涤2次,上流式细胞仪检测。
1.2.7 统计学方法
所有数据计量资料用x±s表示。各组组间比较采用t检验,P < 0.05为差异有统计学意义。
2. 结果
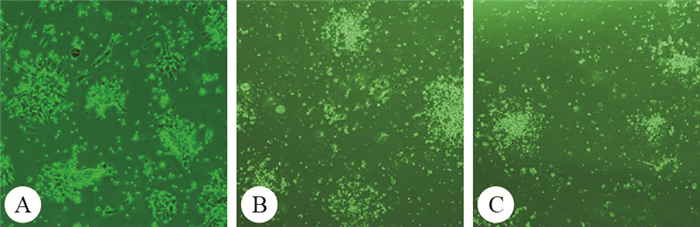
2.1 不同培养基对大鼠BMSCs形态的影响
如图 1所示,观察用DMEM-LG、α-MEM、DMEM/F12完全培养基分别培养的P1、P3和P5大鼠BMSCs发现,P1大鼠BMSCs均表现出形态不均一;当培养至P3时,大鼠BMSCs的形态均一化程度均有所提高,但DMEM-LG完全培养基培养的大鼠BMSCs的形态均一化程度高于α-MEM、DMEM/F12完全培养基培养的BMSCs;而α-MEM、DMEM/F12完全培养基培养的细胞至第5代时,细胞形态才比较均一。提示,DMEM-LG完全培养基更有利于大鼠BMSCs形态的均一化程度。
2.2 不同培养基对大鼠BMSCs克隆形成的影响
见图 2。用DMEM-LG、α-MEM、DMEM/F12完全培养基分别培养原代大鼠BMSCs,观察细胞克隆形成的时间和数量。结果显示,DMEM-LG完全培养基分离培养的大鼠BMSCs形成细胞克隆的平均时间为(7.7±1.5) d,短于用α-MEM、DMEM/F12完全培养基分离培养者〔(10.7±2.1) d和(13.7±2.1) d〕,差异有统计学意义(P < 0.01),而后两者的比较,差异也有统计学意义(P < 0.05)。同时,在培养14 d时,对细胞克隆计数发现,DMEM-LG完全培养基分离培养的大鼠BMSCs形成的细胞克隆数为(14±2)个,高于用α-MEM、DMEM/F12完全培养基分离培养者〔(10±1)个和(6±1)个〕,差异有统计学意义(P < 0.01),而后两者的比较,差异也有统计学意义(P < 0.05)。
2.3 不同培养基对大鼠BMSCs第一次传代时间和增殖的影响
分别用DMEM-LG、α-MEM、DMEM/F12三种完全培养基分离大鼠BMSCs,结果显示,DMEM-LG完全培养基分离培养的大鼠BMSCs在(11.00±1.11) d达到首次传代的融合状态(65%~70%),可进行传代。而用α-MEM、DMEM/F12完全培养基分离培养的大鼠BMSCs分别在(14.00±1.25) d和(17.00±1.67) d才达到首次传代的融合状态。而对DMEM-LG、α-MEM、DMEM/F12三种完全培养基分别培养的P3代生长良好的BMSCs进行细胞生长曲线观察发现(图 3),大鼠BMSCs的生长曲线基本为S型,细胞接种后1~3 d内,OD值逐渐上升,细胞缓慢增殖;3 d后,OD值快速升高,细胞增殖加速。DMEM-LG完全培养基分离培养的BMSCs在第4天进入对数生长期,第6天达到峰值,此时细胞铺满整个培养孔底面的大部分区域,细胞生长曲线显示BMSCs生长进入一个平台期;到第9天时,OD值开始降低,细胞生长曲线显示细胞正在退化衰亡。而用α-MEM、DMEM/F12完全培养基分离培养的大鼠BMSCs至第6天进入对数生长期,第7天和第8天达到峰值。同时,对DMEM-LG、α-MEM、DMEM/F12三种完全培养基分别培养的P3代生长良好的BMSCs进行3 d扩增计数发现,DMEM-LG完全培养基分离培养的BMSCs平均扩增倍数为6.67±1.60,细胞计数达(2.5~3.0)×105 mL-1,3 d总扩增数量达(2.2~2.7)×105 mL-1,而α-MEM、DMEM/F12完全培养基分离培养的大鼠BMSCs扩增倍数分别5.67±1.46、5.20±1.43,细胞计数分别为(1.5~1.7)×105 mL-1、(1.5~1.6)×105 mL-1,3 d总扩增数量分别为(1.2~1.4)×105 mL-1、(1.2~1.3)×105 mL-1。以上结果表明,DMEM-LG完全培养基培养的大鼠BMSCs进入对数生长期时间短,细胞扩增倍数大, 单位时间内细胞扩增数量多, DMEM-LG完全培养基更有利于大鼠BMSCs的增殖。
2.4 不同培养基对大鼠BMSCs贴壁的影响
分别用DMEM-LG、α-MEM、DMEM/F12三种完全培养基分离培养大鼠BMSCs,观察大鼠BMSCs贴壁情况。DMEM-LG完全培养基分离培养的大鼠BMSCs,2 h后贴壁率达(47.0±2.8)%,而用α-MEM、DMEM/F12完全培养基分离培养的大鼠BMSCs 2 h后贴壁率分别为(27.6±2.0)%和(17.3±1.4)%,该结果表明,DMEM-LG完全培养基促进大鼠BMSCs贴壁的能力强于α-MEM(P < 0.05)、DMEM/F12完全培养基(P < 0.05)。
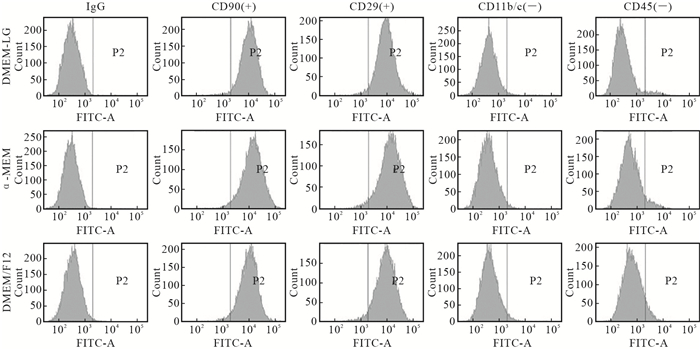
2.5 不同培养基对大鼠BMSCs的表面抗原的影响
DMEM-LG、α-MEM、DMEM/F12培养基培养的P3代大鼠BMSCs均高表达CD90、CD29,其中CD90表达阳性率分别为97.5%、97.3%和97.0%,CD29表达阳性率分别为96.8%、96.6%和95.9%,并低表达CD11b/c、CD45, 其中CD11b/c表达阳性率分别为1.5%、1.9%和2.9%,CD45表达阳性率分别为4.6%、7.2%和8.6%(图 4)。结果显示,DMEM-LG、α-MEM、DMEM/F12培养基对大鼠BMSCs表面抗原的表达无明显影响。
3. 讨论
BMSCs在体外培养和扩增是其在临床和组织工程中应用的基础。通过寻求BMSCs体外培养的合适的环境,能使BMSCs在短时间内得到较高的扩增倍数,得到较多数量的细胞;从而满足临床和组织工程的需要。在诸多影响因素中,培养基是构成细胞体外生存环境最直接的因素。因此,寻求最适合BMSCs生长的培养基的重要性不言而喻。目前用于BMSCs体外培养的培养基主要有以下3种:DMEM-LG、α-MEM和DMEM/F12培养基。不同的培养基其成分组成存在差异。近年来,有研究报道了不同的培养基对BMSCs的影响,但结果并不十分统一[3-5]。本研究主要探讨DMEM-LG、α-MEM、DMEM/F12培养基对大鼠BMSCs生长和增殖的影响差异,结果显示,以DMEM-LG、α-MEM、DMEM/F12分别培养大鼠BMSCs,其细胞形态、克隆形成时间、克隆形成数量、第1次传代的时间、以及相同条件下贴壁率以及生长曲线和扩增倍数、单位时间内扩增数量都存在差异。其中,DMEM-LG培养基培养的大鼠BMSCs形态比较均一,在P3、P5代均一程度均优于其它两组;克隆形成时间最短,14 d克隆形成数量最多,第1次传代的时间也最短。在相同培养条件下,DMEM-LG培养基培养的大鼠BMSCs贴壁率最高,进入对数生长期耗时最短,扩增倍数和3 d总扩增数量最高。有研究表明,进行体外细胞培养时,血清(包括各类蛋白和贴附因子)[5-6]、二价阳离子[7-8]、贴壁介质表面特性[9-11]和培养基pH值[12]等构成影响细胞贴壁的重要因素。其中,培养基pH在诸多因素中显得尤为重要,其对大鼠BMSCs的扩增、分化、成熟以及功能特性的影响较为明显。研究发现DMEM-LG和DMEM/F12的pH值相差0.2~0.3,在加入相同碳酸氢钠情况下,DMEM/F12的pH值明显偏碱,对体外培养大鼠BMSCs的增殖造成不利影响[13-14]。同时,高浓度葡萄糖对细胞的生长也产生不利影响,因为高浓度葡萄糖代谢产生的乳酸较多,从而令干细胞增殖所需的微环境受到较高酸性代谢产物的影响,破坏细胞的生长环境,最终抑制细胞的生长[15]。TENNANT等[16]研究也发现较低浓度的葡萄糖能减少细胞的调亡,有利于细胞的增殖和集落形成。本研究中DMEM-LG、α-MEM、DMEM/F12培养基中葡萄糖质量浓度分别为1 000、1 000、3 151 mg/L,这可能是造成细胞集落形成和生长速度差异的原因之一。此外,培养基中谷氨酰胺对细胞的生长也至关重要,谷氨酰胺缺乏会导致细胞营养不良,甚至死亡[17-18]。在DMEM-LG、α-MEM、DMEM/F12三种培养基中,DMEM-LG培养基中谷氨酰胺浓度(584 mg/L)高于α-MEM(292 mg/L)以及DMEM/F12(365 mg/L)培养基,从而有利于细胞的生长和增殖。本研究结果表明,在DMEM-LG、α-MEM、DMEM/F12三种培养基中,DMEM-LG是较适合大鼠BMSCs生长的培养基。
-
-
[1] PATEL D, SHAH J, SRIVASTAVA A.Therapeutic potential of mesenchymal stem cells in regenerative medicine.Stem Cells Int, 2013, 2013: 496218[2019-09-07].https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3615627/pdf/SCI2013-496218.pdf. doi:10.1155/2013/496218.
[2] 李深, 白玉萌, 蓝晓艳, 等.大鼠骨髓间充质干细胞培养方法的比较.大连医科大学学报, 2014, 36(2):132-136. http://d.old.wanfangdata.com.cn/Periodical/dlykdxxb201402007 [3] ZHANG L, PENG L, WU N, et al.Development of bone marrow mesenchymal stem cell culture in vitro. Chin Med J, 2012, 125(9):1650-1655. http://d.wanfangdata.com.cn/Periodical/zhcmj201209023
[4] 李倩晓, 那荣妹, 刘百亭, 等. SD大鼠骨髓间充质干细胞原代培养条件的选择.中国老年学杂志, 2017, 37(5):1084-1087. DOI: 10.3969/j.issn.1005-9202.2017.05.020 [5] HOCH A, LEACH J.Concise review:optimizing expansion of bone marrow mesenchymal stem/stromal cells for clinical applications. Stem Cells Transl Med, 2014, 3(5):643-652. DOI: 10.5966/sctm.2013-0196
[6] 王娟, 马桂兰, 王家敏.培养基对MDCK细胞贴壁率的影响.甘肃畜牧兽医, 2018, 48(10):75-77. http://d.old.wanfangdata.com.cn/Periodical/gsxmsy201810028 [7] PRIEST A, SHAFRAZ O, SIVASANKAR S. Biophysical basis of cadherin mediated cell-cell adhesion. Exp Cell Res, 2017, 358(1):10-13. DOI: 10.1016/j.yexcr.2017.03.015
[8] BRASCH J, KATSAMBA P, HARRISON O, et al. Homophilic and heterophilic interactions of type Ⅱ cadherins identify specificity groups underlying cell-adhesive behavior. Cell Rep, 2018, 23(6):1840-1852. DOI: 10.1016/j.celrep.2018.04.012
[9] SHOTORBANI B, ALIZADEH E, SALEHI R, et al. Adhesion of mesenchymal stem cells to biomimetic polymers:a review. Mater Sci Eng C Mater Biol Appl, 2017, 71:1192-1200. DOI: 10.1016/j.msec.2016.10.013
[10] 刘洋, 韩东, 华闻达, 等.基底硬度与形貌协同对大鼠骨髓间充质干细胞成骨分化的影响.医用生物力学, 2016, 31(3):218-226. http://d.old.wanfangdata.com.cn/Periodical/yyswlx201603005 [11] JIANG J, PAPOUTSAKIS E. Stem-cell niche based comparative analysis of chemical and nano-mechanical material properties impacting ex vivo expansion and differentiation of hematopoietic and mesenchymal stem cells. Adv Healthc Mater, 2013, 2(1):25-42. http://www.ncbi.nlm.nih.gov/pubmed/23184458
[12] COSTA D, SAVIO L, PRADIER C.Adsorption of amino acids and peptides on metal and oxide surfaces in water environment:a synthetic and prospective review. J Phys Chem B, 2016, 120(29):7039-7052. DOI: 10.1021/acs.jpcb.6b05954
[13] KAGAMI H, AGATA H, INOUE M, et al. The use of bone marrow stromal cells (bone marrow-derived multipotent mesenchymal stromal cells) for alveolar bone tissue engineering:basic science to clinical translation. Tissue Eng Part B Rev, 2014, 20(3):229-232. DOI: 10.1089/ten.teb.2013.0578
[14] HEVEHAN D, WENNING L, MILLER W, et al.Dynamic model of ex vivo granulocytic kinetics to examine the effects of oxygen tension, pH, andinterleukin-3. Exp Hematol, 2000, 28(9):1016-1028. DOI: 10.1016/S0301-472X(00)00505-1
[15] ZHOU Y, TSAI T, LI W. Strategies to retain properties of bone marrow-derived mesenchymal stem cells ex vivo. Ann N Y Acad Sci, 2017, 1409(1):3-17. DOI: 10.1111/nyas.13451
[16] TENNANT G, TRURAN L, BAILRY-WOOD R, et al.Control of pH in human long-term bone marrow cultures with low-glucose medium containing zwitterion buffer lengthens the period of haemopoietic activity. Br J Haematol, 2000, 109(4):785-787. DOI: 10.1046/j.1365-2141.2000.02002.x
[17] DOS SANTOS G, HASTREITER A, SARTORI T, et al.L-glutamine in vitro modulates some immunomodulatory properties of bone marrow mesenchymal stem cells. Stem Cell Rev Rep, 2017, 13(4):482-490. DOI: 10.1007/s12015-017-9746-0
[18] TANG K, HU L, MA J, et al.Brief report: human mesenchymal stem-like cells facilitate floating tumorigenic cell growth via glutamine-ammonium cycle. Stem Cells, 2015, 33(9):2877-2884. DOI: 10.1002/stem.2076

 首页
首页



 下载:
下载: