Study on Clinicopathological Features and Prognostic Factors of Multifocal Lung Cancer
-
摘要:目的 分析多病灶肺癌(multifocal lung cancer,MFLC)的临床病理特征并探究其预后因素。方法 回顾性分析2012年1月−2018年1月四川大学华西医院术后病理诊断为MFLC、且最大病灶直径≤4 cm、无淋巴结转移、无胸膜转移及远处转移的187例患者的临床病理资料。采用Kaplan-Meier方法及多因素Cox风险比例回归模型进行生存分析以评估影响MFLC预后的独立危险因素。结果 187例患者中同时性MFLC 173例,异时性14例。所有患者术后5年无病生存(disease-free survival,DFS)率为63.5%,5年总生存(overall survival,OS)率为89.1%。根据2013版美国胸科医师协会(ACCP)诊断指南诊断同时性多原发肺癌133例,肺内转移癌40例,两组患者的DFS差异无统计学意义(P=0.531)。对于同时性MFLC病例,表皮生长因子受体(epidermal growth factor receptor,EGFR)突变状态(突变相同、突变不同、均野生型)对患者DFS无影响(P=0.388)。两实性结节〔风险比(hazard ratio,HR)
=7.4,95%置信区间:1.7~32.8,P=0.008〕以及异时性癌(HR=5.6,95%置信区间:2.0~15.3,P=0.001)是预后不良(肿瘤复发)的两个独立危险因素。 结论 MFLC早期行手术治疗可获得理想的预后。病灶的影像学密度及病灶发生时序(同时或异时)对预后判断有重要意义。Abstract:Objective To analyze the clinicopathological characteristics and prognostic factors of multifocal lung cancer (MFLC) patients.Methods From January 2012 to January 2018, 187 MFLC patients whose largest lesion diameter was ≤4 cm and without lymphatic involvement or systemic metastases, were retrospectively reviewed. All the patients received surgical treatment. The Kaplan-Meier method was used for survival analysis, and a multivariable Cox proportional hazards regression model was used to assess the independent prognostic factors.Results Among 187 cases, 173 were simultaneous MFLC (SMFLC) and 14 were metachronous MFLC (MMFLC). The 5-year disease-free survival (DFS) and overall survival (OS) rates of this group MFLC patients were 63.5% and 89.1%, respectively. In the SMFLC group, according to the American College of Chest Physicians (ACCP) guidelines (3rd edition), 133 patients were defined as synchronous multiple primary lung cancer (SMPLC) while 40 patients had intrapulmonary metastases, there was no statistical difference in DFS between the two subgroups (P=0.531). EGFR mutation status (same mutations, different mutations, all wild-type) had no statistically significant effect on DFS of SMFLC (P=0.388). Univariate and multivariate regression analysis revealed that radiographic feature of solid nodules (hazard ratio (HR)=7.4, P=0.008) and MMFLC (HR=5.6, P=0.001) were independent risk factors for poor prognosis.Conclusion MFLC can achieve a favorable prognosis with early surgical treatment. Tumor density and metachronous lesions are two important prognostic predictors. -
肺癌是目前世界范围内发病率和死亡率最高的恶性肿瘤[1]。近年来,随着人口老龄化、空气污染加剧及低剂量螺旋CT筛查肺癌的广泛应用,多病灶肺癌(multifocal lung cancer,MFLC)的检出率逐年增高,国外研究报道其占肺癌的0.2%~8%[2]。MFLC是指同一患者肺内不同解剖部位发现两个或两个以上的恶性病灶。对于影像学上同时发现的称为同时性MFLC(synchronous MFLC,SMFLC),反之则为异时性MFLC(metachronous MFLC,MMFLC)。
MFLC可能代表肺内多个独立起源的多原发肺癌(multiple primary lung cancer,MPLC)或肺内转移(复发)癌。正确诊断该类病例对后续治疗方案的选择及预后判断至关重要。特别对于多个病灶直径≤4 cm、且无淋巴结及全身转移的病例,若诊断为多原发,则可不进行术后辅助治疗;若诊断为肺内转移,则需进行术后辅助治疗。目前这类患者的诊断及预后判断对于临床医生仍是一个挑战。本研究基于2013版美国胸科医师协会(ACCP)诊断指南,回顾性分析这类患者的临床病理特征,并对预后因素进行探索,以期为临床诊疗提供参考。
1. 对象和方法
1.1 研究对象
对我院2012年1月−2018年1月术后病理诊断为MFLC(肿瘤最大径≤4 cm)、无淋巴结转移、无胸膜种植转移及远处转移的187例患者进行回顾性分析,所有患者的临床病理资料及生存信息均完整。本研究方案已通过四川大学华西医院生物医学伦理分委会审核(2017年审399号),且已申请免除患者知情同意,保证对患者病情保密及将其临床病理资料仅用于本研究。
1.2 研究方法
通过His系统查询整理患者的病史资料、术前影像学检查结果(胸部CT、腹部CT、头部MRI及放射性核素骨显像)、手术记录、术后病理、表皮生长因子受体(epidermal growth factor receptor, EGFR)基因突变检测结果、临床诊断、术后辅助治疗方案、术后生存状态(若系统无记录则通过电话随访)供后续分析。对于部分病灶数目≥3个的病例,则选择直径更大的2个病灶作为主病灶。
1.2.1 影像学检查
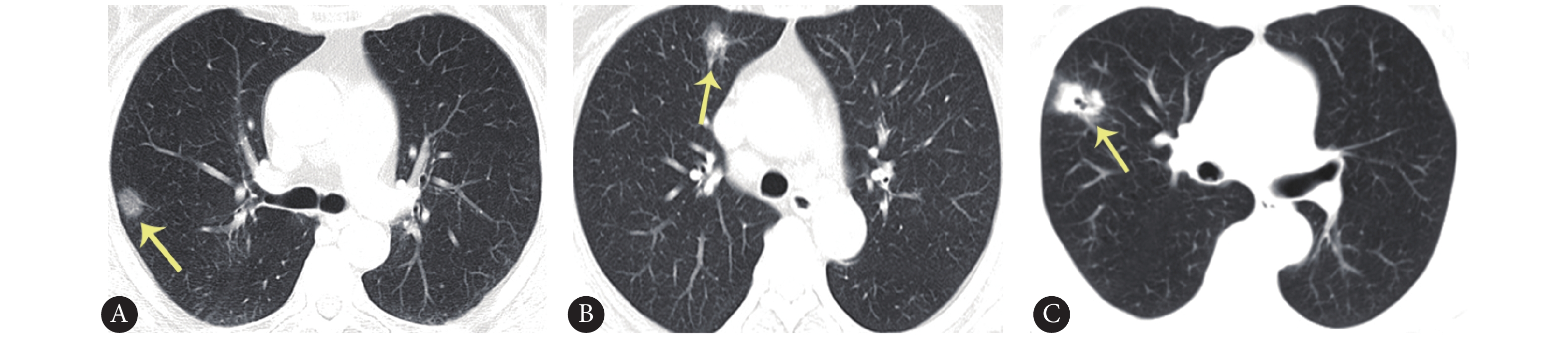
所有患者术前均行常规影像学检查以确定肺部病灶数目、部位、大小、密度,且均已排除肺外远处转移。选择患者术前最近一次胸部CT图像,根据图像显示病灶密度不同可将病灶分为3类:纯磨玻璃结节(全部为磨玻璃成分)、混合性磨玻璃结节(由实性成分和磨玻璃成分共同组成)及实性结节(全部为实性成分)(图1)。前两者可总称为磨玻璃结节。
1.2.2 手术治疗
本研究病例手术方案的选择综合考虑病灶的大小、密度、各病灶位置关系、肺癌发生的时间顺序、患者肺功能等因素。对于多发病灶位于同侧肺的病例,首选手术方案为同时切除多个病灶。而对于两病灶位于不同侧肺的病例,则多进行两期手术,其中直径更大、密度更高的病灶需优先切除,术后根据患者身体恢复情况及余下病灶的生长速度决定二期手术的合适时机。
1.2.3 EGFR突变状态
对于可通过His系统查询到多病灶EGFR检测结果的病例,根据病灶EGFR突变状态将其分为3组:①突变相同:两病灶EGFR突变位点相同;②突变不同:两病灶EGFR突变位点不同或两病灶中一个病灶有EGFR突变而另一个病灶为野生型;③两病灶均为EGFR野生型。
1.2.4 MPLC或肺内转移(复发)鉴别
本研究按2013版ACCP诊断指南诊断或鉴别诊断MPLC或肺内转移(复发)[3]。根据该指南,组织学类型不同(腺癌或鳞癌)或分子遗传学特征不同(EGFR突变不同)的两病灶为MPLC;组织学类型相同时,MPLC必须位于不同肺叶、起源于不同的原位癌、无N2/N3淋巴结受累及肺外转移,其中异时性MPLC需间隔≥4年。
1.2.5 随访
所有患者随访包括其临床症状和影像学检查结果。随访周期前两年为每4个月随访1次,之后每6个月1次,随访截止至2019年6月。无进展生存期(disease-free survival, DFS)定义为末次手术日期(异时性肺癌及病灶位于两侧肺叶的病例行分期手术)至肿瘤复发或末次影像学随访的时间。总生存期(overall survival, OS)为末次手术至肺癌相关死亡或末次随访的时间。
1.3 统计学方法
计量资料用中位数及范围表示。分类资料用例数及百分比表示,采用χ2检验进行构成比的比较。生存分析选择Kaplan-Meier统计方法,应用log-rank检验评估患者临床、影像学检查、病理等因素对预后是否有影响,进一步采用Cox风险比例回归模型进行多因素分析以评估MFLC的独立预后因素。P<0.05为差异有统计学意义。
2. 结果
2.1 临床病理特征
187例患者中双病灶肺癌146例,三病灶31例,余下10例患者病灶≥4个。多数病例(173例)为SMFLC,MMFLC仅为14例。发病年龄为30~79岁,中位年龄为61岁。病例中女性121例(64.7%),男性66例(35.3%),女性患者发病率明显高于男性。44例患者有吸烟史,84例患者有肿瘤家族史,13例患者同时有其他恶性肿瘤病史。两病灶位于同侧肺不同肺叶的病例数最多(91例),其次是位于同一肺叶(58例)及位于不同侧肺(38例)。CT图像显示为多个磨玻璃结节的患者68例、磨玻璃结节+实性结节者60例、多个实性结节者59例。多数患者(116例)的最大病灶T分期为T1,余下71例患者为T2a。另外,病理类型以腺癌组合的病例最多(177例),双病灶鳞癌较少(6例),两病灶分别为腺癌及鳞癌的病例也较少(4例),后两者均见于长期吸烟的男性患者。通过His系统可查询到97例患者有多病灶的EGFR检测结果,其中SMFLC为84例,MMFLC为13例。见表1。
表 1 患者的临床病理特征Table 1. Clinicopathological characteristics of patientsCharacteristic Case % Gender Male 66 35.3 Female 121 64.7 Smoking history Yes 44 23.5 No 143 76.5 Family cancer history Yes 84 49.7 No 85 50.3 Tumor history Yes 13 7.5 No 174 92.5 Location of lesions One lobe 58 31.0 Unilateral different lobe 91 48.7 Bilateral lobe 38 20.3 Radiologic features Multiple GGN 68 36.4 SN+GGN 60 32.1 Multiple SN 59 31.6 T stage of largest tumor T1 116 62.0 T2a 71 38.0 Detailed histology AC+AC 177 94.7 AC+SCC 4 2.1 SCC+SCC 6 3.2 EGFR mutation Positive 59 60.8 Pan-wild type 38 39.2 GGN: Ground glass nodule; SN: Solid nodule; AC: Adenocarcinoma; SCC: Squamous cell carcinoma; EGFR: Epidermal growth factor receptor. 2.2 手术治疗
根据手术记录,187例患者中61例患者行多病灶亚肺叶切除(肺段或楔形切除),39例患者选择肺叶切除(单叶或双叶切除),87例患者接受肺叶联合亚肺叶切除术。38例患者(包括14例MMFLC及24例病灶位于不同侧肺的患者)行两期手术,两次手术间隔时间平均约17个月(2~52个月)。本研究纳入患者术中均行淋巴结清扫。
2.3 术后辅助治疗
本研究中133例患者术后未行化疗及靶向治疗,术后进行规律随访。47例患者接受术后化疗,其中35例术后诊断为ⅠB期、且有复发高危因素(肿瘤为低分化或镜下见脉管癌拴或有脏层胸膜受累),故行辅助化疗;另有12例患者其最大病灶T分期为T1,因临床医生不能明确排除其多病灶为肺内转移癌的可能,故为减少复发风险而行术后化疗。
另有7例患者因临床医生判断其为肺内转移癌,因而行EGFR靶向治疗,病例详细信息见表2。值得注意的是,7例患者仅病例3在手术后46个月出现了复发,其余6例患者均未出现复发。另外,6例患者(病例1~6)的多个病灶位于不同肺叶,根据ACCP诊断标准均被诊断为MPLC。
表 2 7例行EGFR靶向治疗病例的临床及预后信息Table 2. Clinical and prognostic details of 7 patients undergoing EGFR targeted therapyCase Sex Smoking history Tumor sites Nodule intensity EGFR mutations T-stage of lesions ACCP guidelines Follow-up/month Relapsed or not 1 F No RML/LUL GGN+GGN 19-del/unknown Tis/Tis MPLC 68 Not 2 F No LUL/RLL GGN+SN 19-del/unknown Tis/T1a MPLC 33 Not 3 F No RML/RLL SN+SN 19-del/unknown T1c/T1a MPLC 46 Relapsed 4 F No RML/RLL GGN+SN L858R/L858R T1b/T1c MPLC 20 Not 5 F No RUL/RLL SN+GGN 19-del/unknown T2 visc./Tis MPLC 51 Not 6 M Yes RML/RLL SN+SN Wild/19-del T2 visc./T1a MPLC 24 Not 7 F No RUL/RUL GGN+SN 19-del/19-del T1b/T2a Metastasis 50 Not F: Female; M: Male; RML: Right middle lobe; LUL: Left upper lobe; RLL: Right lower lobe; RUL: Right upper lobe; GGN: Ground glass nodule; SN: Solid nodule; MPLC: Multiple primary lung cancer; EGFR: Epidermal growth factor receptor; ACCP: American College of Chest Physicians. 2.4 预后分析
患者中位随访时间为28(8~71)个月。术后5年DFS率为63.5%,5年OS率为89.1%。随访期内共观察到25例患者出现肿瘤复发,仅4例患者出现肺癌相关的死亡,故本研究主要对DFS的影响因素进行分析。
2.4.1 单因素分析
结果见表3。MMFLC患者(P<0.001)、主要病灶T分期为T2a者(P=0.001)、实性结节数目越多者(P<0.001)和接受术后化疗者(P=0.006)其5年DFS率更低。年龄、病灶数目、病灶位置关系、诊断结论(根据2013版ACCP指南)、EGFR突变状态等因素对DFS无影响。
表 3 MFLC患者DFS的单因素分析Table 3. Univariate analysis of disease-free survival (DFS) in patients with MFLCVariable Case 5 year-DFS
rate/%P Age/yr. 0.770 <61 95 42.2 ≥61 92 77.7 Number of lesions 0.321 2 146 71.5 ≥3 41 36.9 Tumor location 0.429 One lobe 58 76.8 Ipsilateral different lobe 91 49.9 Contralateral lobe 38 76.8 Time of presence <0.001 Synchronous 173 66.2 Metachronous 14 0 T stage of major lesion 0.001 T1 116 80.0 T2a 71 40.0 Density pattern of tumors <0.001 GGN+GGN 68 94.6 GGN+SN 60 87.8 SN+SN 59 25.2 EGFR mutation status 0.388 Concordant 27 66.4# Discordant 26 87.0 Pan-wild type 31 30.5 Diagnosis by ACCP 0.531 MPLC 133 60.5 Metastases 40 69.3 Treatment 0.006 None 133 80.1 Chemotherapy 47 34.7 Targeted therapy 7 75.0 GGN, SN, MPLC, ACCP: The same notes as table 2; #DFS rate at 4-year was calculated in a 50 months’ follow-up period. 由于异时性患者的DFS较同时性肺癌患者更差,且异时性病例仅14例,故分析EGFR突变状态以及ACCP诊断结论对DFS的影响时仅纳入SMFLC病例。此外,对上述各亚组病例病灶密度组合的构成比进行比较,如表4所示:不同EGFR突变状态的3组患者及ACCP标准诊断的MPLC与肺内转移癌的2组患者其病灶密度组合的构成比差异无统计学意义。
表 4 不同EGFR突变状态及不同诊断(ACCP标准)亚组病例的病灶密度组合的分布Table 4. Lesion density of subgroups stratified by EGFR mutation and ACCP guidelinesVariable Overall GGN+GGN GGN+SN SN+SN P EGFR mutation status 0.784 Concordant/case 27 6 7 14 Discordant/case 26 6 10 10 Pan-wild type/case 31 9 8 14 Diagnosis by ACCP 0.094 MPLC/case 133 54 46 33 Metastases/case 40 13 10 17 GGN, SN, MPLC, ACCP: The same notes as table 2. 2.4.2 多因素分析
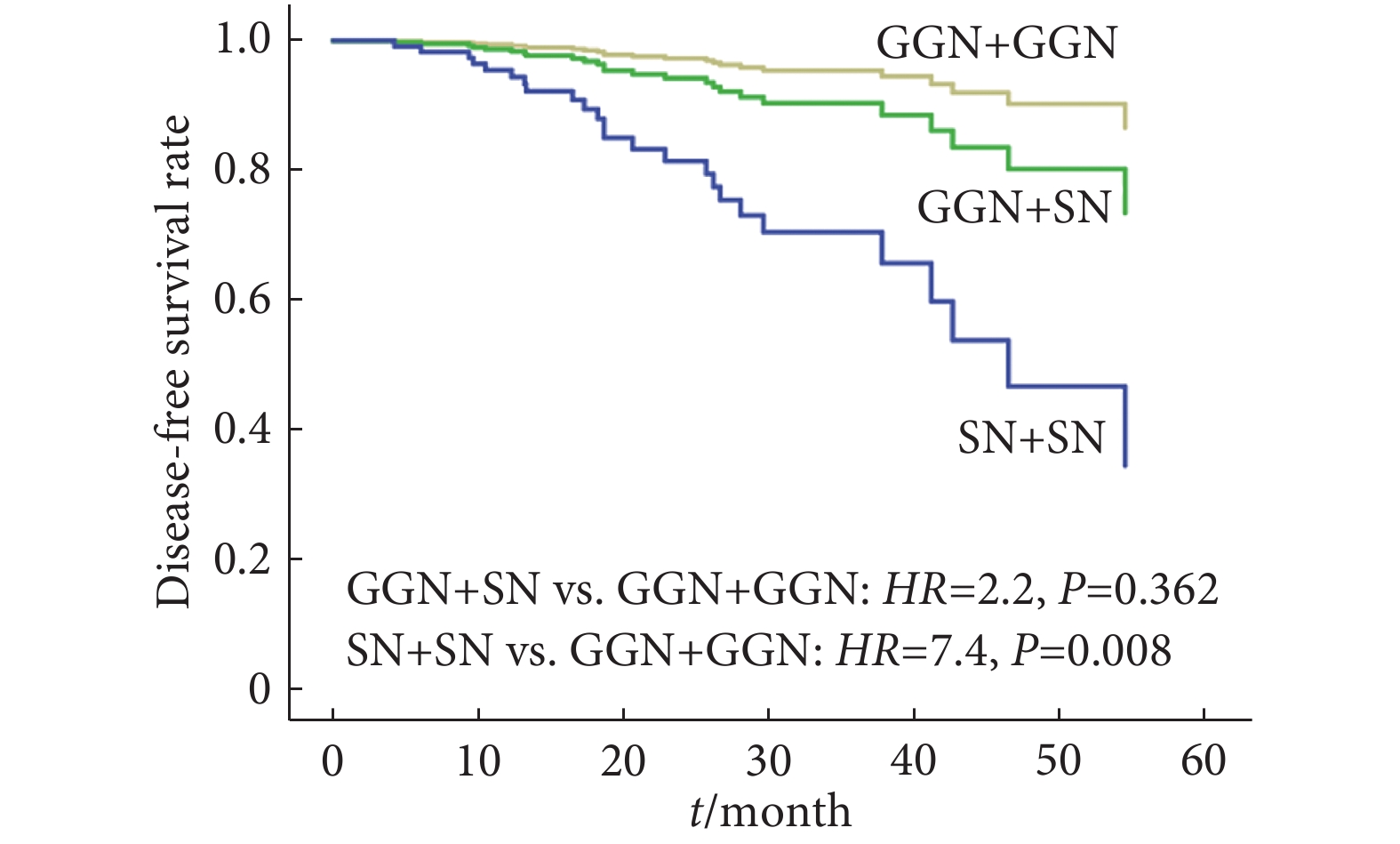
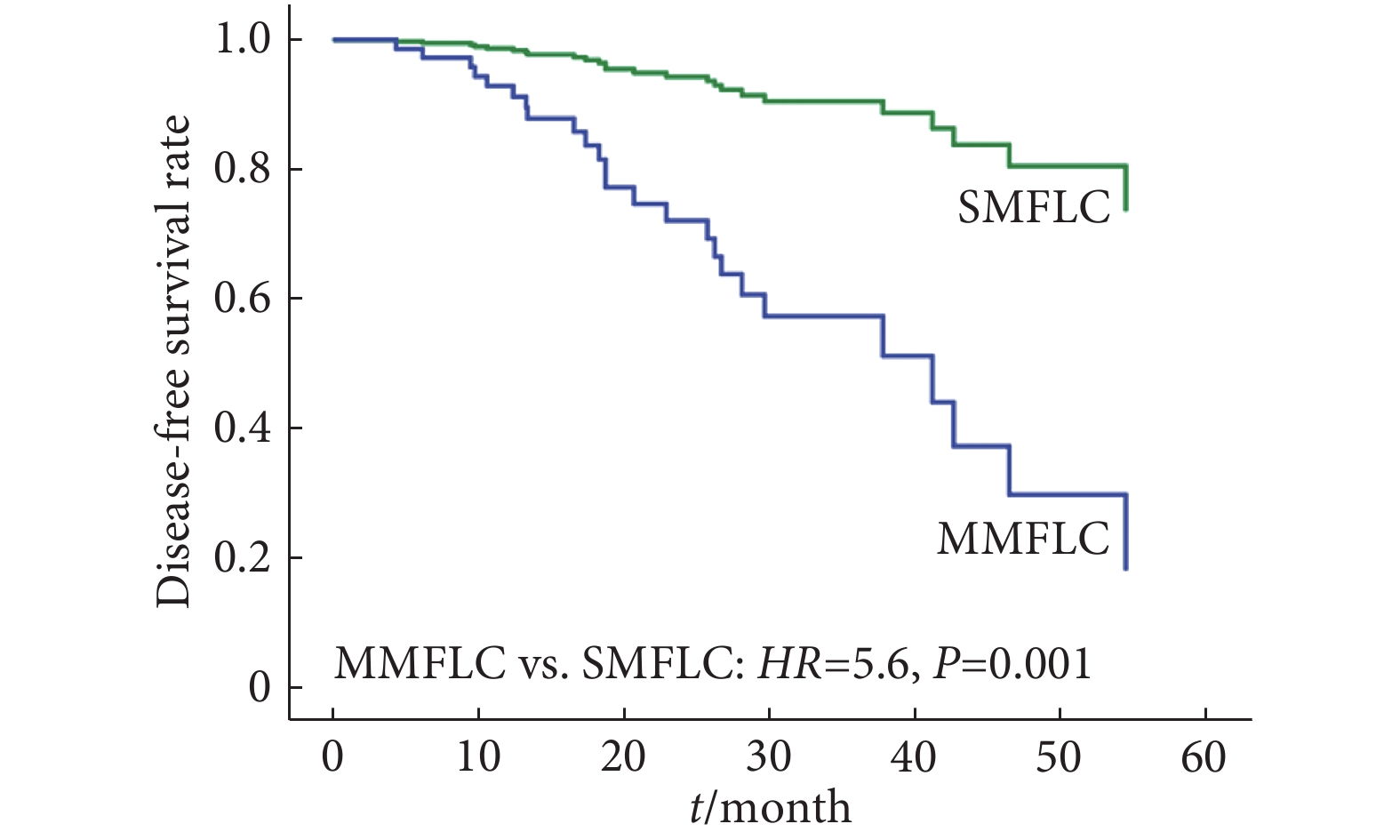
进一步应用Cox比例风险回归模型对预后因素进行多因素分析,将患者病灶出现时间、病灶密度组合方式、主要病灶T分期以及术后治疗方式这4个变量纳入分析,以排除单因素分析中各因素对预后的相互影响。Cox回归生存曲线(图2、图3)显示,两实性结节〔风险比(hazard ratio, HR)=7.4,95%置信区间:1.7~32.8,P=0.008〕、MMFLC(HR=5.6,95%置信区间:2.0~15.3,P=0.001)是肿瘤复发的两个独立危险因素。主要病灶T分期(P=0.169)以及术后辅助化疗与否(P=0.415)对DFS无影响。
3. 讨论
近年来,MFLC的发病率明显上升。MFLC可能代表多原发肺癌或肺癌肺内转移,正确诊断及评估该类患者的预后对于临床医生非常重要且具有挑战性。根据美国癌症联合会(AJCC)第8版肺癌分期[4],对于发生肺内转移的病例,若原发病灶与转移灶位于同一肺叶,则T分期为T3;若原发病灶与转移灶位于同一侧肺的不同肺叶,则诊断为T4;若两病灶位于不同侧肺,则诊断为M1。这类患者需行术后辅助治疗以减少复发风险。相反,若判断MFLC的多个病灶独立起源于不同的祖细胞克隆(多原发肺癌),则对MFLC的多个病灶分别进行TNM分期,根据其中最高的TNM分期决定后续治疗方案[5]。本研究纳入病例的特点为:多病灶肺癌(肿瘤最大径≤4 cm)、无淋巴结转移、无胸膜种植转移及远处转移。对于此类患者若诊断为多原发,若无高危因素则可不进行术后辅助治疗;若诊断为肺内转移,则需进行术后辅助治疗。故针对此类患者开展研究具有重要意义。
本研究总结分析187例MFLC患者的临床病理资料,结果显示:①患者诊断的中位年龄为61岁,与KANG等[6]的报道几乎一致;②女性患者及不吸烟的患者占比更高;③病灶组织学类型以腺癌最常见,亦与多个研究相符[7-9]。另外,鉴于MFLC是肺癌中一类特殊的病例,关于其发病机制目前仍不清楚,故本研究进一步对患者的肿瘤家族史及合并其他肿瘤情况进行统计并与既往文献进行对比,以期对遗传相关因素进行探索。在169例可提供准确肿瘤家族史的病例中,近一半(49.7%)的患者肿瘤家族史为阳性。13例(7.5%)患者合并有除肺癌外的其他解剖部位的恶性肿瘤。结合既往的研究数据:GANTI等[10]报道26.4%(48/562)的肺癌患者有肿瘤家族史,LIU等[11]统计22 405例癌症患者中多重癌的占比为0.86%,另有文献报道2.5%~15.2%的肺癌患者合并患有其他恶性肿瘤[12-13]。综上,本研究中MFLC病例合并肿瘤家族史的比例较GANTI等报道的比例更高,但由于缺乏更多的研究数据支持,故MFLC是否更易合并家族恶性肿瘤仍有待进一步研究。此外结合上述数据,目前尚不能确定MFLC患者是否更易罹患其他恶性肿瘤。
对MFLC病例进行生存分析显示:术后5年DFS率为63.5%,5年OS率为89.1%。这一结果提示对于多病灶直径≤4 cm、无淋巴结转移、无胸膜及肺外转移的患者,外科手术治疗及对有复发高危因素的患者行辅助化疗可获得较好的预后。另外,本研究中病例影像学呈现两实性结节(P=0.008)、异时性癌(P=0.001)是预后不良的两个独立危险因素。HATTORI等[9]和CHEN等[14]的研究也表明MFLC有两个或多个实性结节是预后不良的重要危险因素。对于这类实性结节的手术治疗,HATTORI等[15]提出应行肺叶切除以减少术后复发。
目前,鉴别多病灶肺癌为MPLC或肺内转移癌的诊断方法尚存在争议。最早的诊断标准由MARTINI等[16]于1975年首次提出。后来ACCP在MARTINI标准的基础上进行更新[3, 17-18],建议可采用特异的分子标记物或基因检测来分析病灶的分子遗传学特征,如微卫星不稳定、杂合性缺失分析、微阵列比较基因组杂交等;同时提出可通过肺腺癌的主要组织学亚型(如贴壁型、乳头型、腺泡型、微乳头型、实体型)是否相同对多病灶的克隆起源关系进行判断。目前2013版ACCP诊断指南较广泛应用于临床,本研究亦采用这一指南对SMFLC为多原发或肺癌转移进行重新评估并对两组患者进行生存分析。一项由国际肺癌协会(IASLC)主导的基于大样本肺癌病例的回顾性研究曾经报道肺内转移的患者相比多原发病例的预后更差[19],然而本研究基于ACCP指南判断为多原发及肺癌转移两组患者的DFS差异无统计学意义。这一结果提示ACCP诊断指南对MFLC病例的诊断及预后判断可能有一定局限性。近年来,有学者也对这一诊断方法提出质疑并探索应用分子标记物对这一类病例进行诊断。
多个研究通过检测多病灶腺癌的驱动基因如EGFR、K-ras、TP53的突变状态对各病灶的克隆起源关系进行判断[20-23]。这些研究认为:多病灶肺癌若有相同的基因突变,则两者来源于同一克隆起源(肺内转移);反之若两病灶突变不同(一个病灶为突变型另一个病灶为野生型或发生不同位点的突变),则两者为独立起源(多原发癌);当病灶均为野生型时,则不能判断其克隆关系。上述驱动基因中EGFR作为肺癌的高频突变,SHI等[24]报道其在亚裔肺腺癌患者中突变率高达51.4%,故本研究对84例SMFLC病例根据EGFR突变状态分组进行生存分析,结果示3组患者(EGFR突变相同、不同、均野生型)的DFS无明显差异。分析出现这一结果的可能原因为:同一患者的两个病灶有相同的EGFR突变时,由于受相同的遗传背景和致癌物质暴露的影响,该两病灶很有可能起源于不同的原发病灶而并非肺内转移。此外,当两病灶均为野生型时,也不能通过单个驱动突变的状态对多病灶的克隆起源关系进行判断。
近年来,随着二代测序的发展,有学者提出应用50个肿瘤热点基因检测panel[25-27]或全外显子组测序对MFLC病例病灶间克隆关系进行判断[28-29]。这些研究为临床医生对该类疾病的诊断提供了新的思路。
综上,本研究发现对于多病灶直径≤4 cm、无淋巴结转移、无胸膜及肺外转移的肺癌患者,接受外科手术治疗可获得较好的预后。术前影像显示病灶为多个实性结节以及异时性病例的复发风险更高。此外,未来的研究需探索更好的鉴别诊断MPLC和肺内转移癌的方法,这对临床医生进行治疗决策及预后判断非常重要。
-
表 1 患者的临床病理特征
Table 1 Clinicopathological characteristics of patients
Characteristic Case % Gender Male 66 35.3 Female 121 64.7 Smoking history Yes 44 23.5 No 143 76.5 Family cancer history Yes 84 49.7 No 85 50.3 Tumor history Yes 13 7.5 No 174 92.5 Location of lesions One lobe 58 31.0 Unilateral different lobe 91 48.7 Bilateral lobe 38 20.3 Radiologic features Multiple GGN 68 36.4 SN+GGN 60 32.1 Multiple SN 59 31.6 T stage of largest tumor T1 116 62.0 T2a 71 38.0 Detailed histology AC+AC 177 94.7 AC+SCC 4 2.1 SCC+SCC 6 3.2 EGFR mutation Positive 59 60.8 Pan-wild type 38 39.2 GGN: Ground glass nodule; SN: Solid nodule; AC: Adenocarcinoma; SCC: Squamous cell carcinoma; EGFR: Epidermal growth factor receptor. 表 2 7例行EGFR靶向治疗病例的临床及预后信息
Table 2 Clinical and prognostic details of 7 patients undergoing EGFR targeted therapy
Case Sex Smoking history Tumor sites Nodule intensity EGFR mutations T-stage of lesions ACCP guidelines Follow-up/month Relapsed or not 1 F No RML/LUL GGN+GGN 19-del/unknown Tis/Tis MPLC 68 Not 2 F No LUL/RLL GGN+SN 19-del/unknown Tis/T1a MPLC 33 Not 3 F No RML/RLL SN+SN 19-del/unknown T1c/T1a MPLC 46 Relapsed 4 F No RML/RLL GGN+SN L858R/L858R T1b/T1c MPLC 20 Not 5 F No RUL/RLL SN+GGN 19-del/unknown T2 visc./Tis MPLC 51 Not 6 M Yes RML/RLL SN+SN Wild/19-del T2 visc./T1a MPLC 24 Not 7 F No RUL/RUL GGN+SN 19-del/19-del T1b/T2a Metastasis 50 Not F: Female; M: Male; RML: Right middle lobe; LUL: Left upper lobe; RLL: Right lower lobe; RUL: Right upper lobe; GGN: Ground glass nodule; SN: Solid nodule; MPLC: Multiple primary lung cancer; EGFR: Epidermal growth factor receptor; ACCP: American College of Chest Physicians. 表 3 MFLC患者DFS的单因素分析
Table 3 Univariate analysis of disease-free survival (DFS) in patients with MFLC
Variable Case 5 year-DFS
rate/%P Age/yr. 0.770 <61 95 42.2 ≥61 92 77.7 Number of lesions 0.321 2 146 71.5 ≥3 41 36.9 Tumor location 0.429 One lobe 58 76.8 Ipsilateral different lobe 91 49.9 Contralateral lobe 38 76.8 Time of presence <0.001 Synchronous 173 66.2 Metachronous 14 0 T stage of major lesion 0.001 T1 116 80.0 T2a 71 40.0 Density pattern of tumors <0.001 GGN+GGN 68 94.6 GGN+SN 60 87.8 SN+SN 59 25.2 EGFR mutation status 0.388 Concordant 27 66.4# Discordant 26 87.0 Pan-wild type 31 30.5 Diagnosis by ACCP 0.531 MPLC 133 60.5 Metastases 40 69.3 Treatment 0.006 None 133 80.1 Chemotherapy 47 34.7 Targeted therapy 7 75.0 GGN, SN, MPLC, ACCP: The same notes as table 2; #DFS rate at 4-year was calculated in a 50 months’ follow-up period. 表 4 不同EGFR突变状态及不同诊断(ACCP标准)亚组病例的病灶密度组合的分布
Table 4 Lesion density of subgroups stratified by EGFR mutation and ACCP guidelines
Variable Overall GGN+GGN GGN+SN SN+SN P EGFR mutation status 0.784 Concordant/case 27 6 7 14 Discordant/case 26 6 10 10 Pan-wild type/case 31 9 8 14 Diagnosis by ACCP 0.094 MPLC/case 133 54 46 33 Metastases/case 40 13 10 17 GGN, SN, MPLC, ACCP: The same notes as table 2. -
[1] CORTES J, PEREZ-GARCÍA J M, LLOMBART-CUSSAC A, et al. Enhancing global access to cancer medicines. CA Cancer J Clin,2020,70(2): 105–124. DOI: 10.3322/caac.21597
[2] WARTH A, MACHER-GOEPPINGER S, MULEY T, et al. Clonality of multifocal nonsmall cell lung cancer: implications for staging and therapy. Eur Respir J,2012,39(6): 1437–1442. DOI: 10.1183/09031936.00105911
[3] KOZOWER B D, LARNER J M, DETTERBECK F C, et al. Special treatment issues in non-small cell lung cancer: diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest, 2013, 143(5 Suppl): e369S-e399S[2020-02-15]. https://doi.org/10.1378/chest.12-2362.
[4] GOLDSTRAW P, CHANSKY K, CROWLEY J, et al. The IASLC Lung Cancer Staging Project: proposals for revision of the TNM stage groupings in the forthcoming (Eighth) edition of the TNM classification for lung cancer. J Thorac Oncol,2016,11(1): 39–51. DOI: 10.1016/j.jtho.2015.09.009
[5] RAMI-PORTA R, ASAMURA H, TRAVIS W D, et al. Lung cancer-major changes in the American Joint Committee on Cancer eighth edition cancer staging manual. CA Cancer J Clin,2017,67(2): 138–155. DOI: 10.3322/caac.21390
[6] KANG X, ZHANG C, ZHOU H, et al. Multiple pulmonary resections for synchronous and metachronous lung cancer at two Chinese centers. Ann Thorac Surg,2020,109(3): 856–863. DOI: 10.1016/j.athoracsur.2019.09.088
[7] 郎杉, 孙军平, 王娟, 等. 多原发肺癌临床特点及预后分析. 解放军医学院学报,2016,37(5): 421–424. DOI: 10.3969/j.issn.2095-5227.2016.05.004 [8] TANVETYANON T, FINLEY D, FABIAN T, et al. Prognostic factors for survival after complete resections of synchronous lung cancers in multiple lobes: pooled analysis based on individual patient data. Ann Oncol,2013,24(4): 889–894. DOI: 10.1093/annonc/mds495
[9] HATTORI A, MATSUNAGA T, TAKAMOCHI K, et al. Radiological classification of multiple lung cancers and the prognostic impact based on the presence of a ground glass opacity component on thin section computed tomography. Lung Cancer,2017,113: 7–13. DOI: 10.1016/j.lungcan.2017.09.001
[10] GANTI A K, LOBERIZA F R, Jr, KESSINGER A. Association of positive family history with survival of patients with lung cancer. Lung Cancer,2009,63(1): 136–139. DOI: 10.1016/j.lungcan.2008.04.008
[11] LIU Y Y, CHEN Y M, YEN S H, et al. Multiple primary malignancies involving lung cancer-clinical characteristics and prognosis. Lung Cancer,2002,35(2): 189–194. DOI: 10.1016/S0169-5002(01)00408-1
[12] WANG H, HOU J, ZHANG G, et al. Clinical characteristics and prognostic analysis of multiple primary malignant neoplasms in patients with lung cancer. Cancer Gene Ther,2019,26(11/12): 419–426.
[13] SHOJI F, YAMAZAKI K, MIURA N, et al. Postoperative management of multiple primary cancers associated with non-small cell lung cancer. Anticancer Res,2018,38(6): 3773–3778. DOI: 10.21873/anticanres.12660
[14] CHEN K, CHEN W, CAI J, et al. Favorable prognosis and high discrepancy of genetic features in surgical patients with multiple primary lung cancers. J Thorac Cardiovasc Surg,2018,155(1): 371–379.e1. DOI: 10.1016/j.jtcvs.2017.08.141
[15] HATTORI A, MATSUNAGA T, TAKAMOCHI K, et al. Locoregional recurrence after segmentectomy for clinical-T1aN0M0 radiologically solid non-small-cell lung carcinoma. Eur J Cardiothorac Surg,2017,51(3): 518–525.
[16] MARTINI N, MELAMED M R. Multiple primary lung cancers. J Thorac Cardiovasc Surg,1975,70(4): 606–612. DOI: 10.1016/S0022-5223(19)40289-4
[17] SHEN K R, MEYERS B F, LARNER J M, et al. Special treatment issues in lung cancer: ACCP evidence-based clinical practice guidelines (2nd edition). Chest,2007,132(3 Suppl): 290S–305S. DOI: 10.1378/chest.07-1382
[18] DETTERBECK F C, JONES D R, KERNSTINE K H, et al. Special treatment issues. Chest,2003,123(1): 244S–258S. DOI: 10.1378/chest.123.1_suppl.244S
[19] EBERHARDT W E, MITCHELL A, CROWLEY J, et al. The IASLC lung cancer staging project: proposals for the revision of the M descriptors in the forthcoming eighth edition of the TNM classification of lung cancer. J Thorac Oncol,2015,10(11): 1515–1522. DOI: 10.1097/JTO.0000000000000673
[20] TAKAMOCHI K, OH S, MATSUOKA J, et al. Clonality status of multifocal lung adenocarcinomas based on the mutation patterns of EGFR and K-Ras. Lung Cancer,2012,75(3): 313–320. DOI: 10.1016/j.lungcan.2011.08.007
[21] LIN M W, WU C T, KUO S W, et al. Clinicopathology and genetic profile of synchronous multiple small adenocarcinomas: implication for surgical treatment of an uncommon lung malignancy. Ann Surg Oncol,2014,21(8): 2555–2562. DOI: 10.1245/s10434-014-3642-5
[22] WU C T, LIN M W, HSIEH M S, et al. New aspects of the clinicopathology and genetic profile of metachronous multiple lung cancers. Ann Surg,2014,259(5): 1018–1024. DOI: 10.1097/SLA.0000000000000385
[23] ASMAR R, SONETT J R, SINGH G, et al. Use of oncogenic driver mutations in staging of multiple primary lung carcinomas: a single-center experience. J Thorac Oncol,2017,12(10): 1524–1535. DOI: 10.1016/j.jtho.2017.06.012
[24] SHI Y, AU J S, THONGPRASERT S, et al. A prospective, molecular epidemiology study of EGFR mutations in Asian patients with advanced non–small-cell lung cancer of adenocarcinoma histology (PIONEER). J Thorac Oncol,2014,9(2): 154–162. DOI: 10.1097/JTO.0000000000000033
[25] PATEL S B, KADI W, WALTS A E, et al. Next-generation sequencing: a novel approach to distinguish multifocal primary lung adenocarcinomas from intrapulmonary metastases. J Mol Diagn,2017,19(6): 870–880. DOI: 10.1016/j.jmoldx.2017.07.006
[26] EGUREN-SANTAMARIA I, SANCHEZ-BAYONA R, PATINO-GARCIA A, et al. Targeted DNA sequencing for assessing clonality in multiple lung tumors: a new approach to an old dilemma. Lung Cancer,2018,122: 120–123. DOI: 10.1016/j.lungcan.2018.05.029
[27] ROEPMAN P, HEUVEL A T, SCHEIDEL K C, et al. Added value of 50-gene panel sequencing to distinguish multiple primary lung cancers from pulmonary metastases—a systematic investigation. J Mol Diagn,2018,20(4): 436–445. DOI: 10.1016/j.jmoldx.2018.02.007
[28] MA P, FU Y, CAI M C, et al. Simultaneous evolutionary expansion and constraint of genomic heterogeneity in multifocal lung cancer. Nat Commun, 2017, 8(1): 823[2020-02-20]. https://www.nature.com/articles/s41467-017-00963-0. doi: 10.1038/s41467-017-00963-0.
[29] LIU Y, ZHANG J, LI L, et al. Genomic heterogeneity of multiple synchronous lung cancer. Nat Commun, 2016, 7: 13200[2020-02-20]. https://doi.org/10.1038/ncomms13200.
-
期刊类型引用(5)
1. 韦梅娟,尹海鹰,农洁金,宁静,林舒丽. 互联网+多元联动延续性护理模式在肺癌靶向药物治疗病人中的应用效果. 全科护理. 2024(07): 1254-1257 .  百度学术
百度学术
2. 王雨楠,陈成,胡威. 小细胞肺癌治疗现状与展望. 遵义医科大学学报. 2023(06): 624-630+636 .  百度学术
百度学术
3. 刘涛,王亚军. 肺腺癌患者血清TFF3的表达水平及其预后意义. 安徽医学. 2023(07): 782-786 .  百度学术
百度学术
4. 薛辉,阚炳华,高翔,朱宏财. 肺癌患者围化疗期SIRT3、ATF2的表达变化对预后的预测价值. 临床和实验医学杂志. 2023(23): 2489-2493 .  百度学术
百度学术
5. 王燕,鲁钰莹,杨丽丽,马会民. 健康体检人群肺癌危险因素的调查与分析. 肿瘤基础与临床. 2021(06): 505-508 .  百度学术
百度学术
其他类型引用(2)

 首页
首页


 下载:
下载: