-
摘要:目的 针对硫酸氢氯吡格雷水溶性差的特点,通过将硫酸氢氯吡格雷制备成脂质体,提供一种可供血管内注射给药的硫酸氢氯吡格雷制剂。方法 采用薄膜水化超声法和pH梯度法制备载硫酸氢氯吡格雷脂质体,考察其形态、粒径、包封率、载药量、Zeta电位和体外释药行为。采用微型动脉夹夹闭大鼠双侧肾蒂的方法建立雄性SD大鼠肾缺血再灌注损伤模型,初步考察硫酸氢氯吡格雷脂质体预处理对大鼠肾缺血再灌注损伤的影响。结果 硫酸氢氯吡格雷脂质体的最佳处方和工艺为:药脂比为1∶10,磷脂和胆固醇之比为6∶1,十八胺和聚乙二醇400与药物的质量比为1.2∶1和1∶1,孵育时间40 min,孵育温度50 ℃,超声条件为100 W、间隔5 s工作20次,0.1 mol/L柠檬酸pH3.0缓冲液5 mL,采用薄膜分散法制备脂质体样品,并进行pH梯度主动载药,pH值调至7.5。此条件下制备的脂质体微粒圆整,分散性好,平均粒径为(134.13±2.60) nm,多分散系数(polydispersity index, PDI)为0.25±0.02,Zeta电位为(2.12±0.23) mV,包封率为(98.66±0.14)%,载药量为(7.47±0.01)%。体外释放实验结果显示72 h内硫酸氢氯吡格雷脂质体的累积释放率约66.24%。初步药效实验表明经氯吡格雷脂质体预处理的造模大鼠血清肌酐和尿素氮水平较未经处理的造模大鼠低。结论 成功制备了硫酸氢氯吡格雷脂质体,为开发硫酸氢氯吡格雷注射液提供了实验基础。Abstract:Objective To prepare encapsulated clopidogrel bisulfate (CLP) liposomes so as to deal with the poor water solubility of CLP, and to provide the experimental basis for the development of CLP formulations for intravascular injection.Methods CLP-loaded liposomes were prepared using thin film hydration/sonication method and pH gradient active drug loading technology. Then, the morphology, particle size, encapsulation efficiency, drug loading capacity, Zeta potentials and in vitro release behavior were characterized. Bilateral renal arteries of Sprague-Dawley (SD) rats were clamped with micro-artery clamps to establish the model of renal ischemia-reperfusion injury (IRI) in male SD rats. The study aimed to preliminarily investigate the therapeutic effect of CLP-loaded liposome pretreatment on renal IRI in rats.Results It was found that the optimal formulation and preparation technology of CLP liposomes were as follows: the CLP-to-phospholipid weight ratio of 1∶10, phospholipid-to-cholesterol ratio of 6∶1, octadecylamine-to-CLP ratio of 1.2∶1, PEG400-to-CLP ratio of 1∶1, and incubation at 50 ℃ for 40 min. Then, following ultrasonication of 100 W efficiency at 5-second intervals for 20 times, CLP loading was conducted using 5 mL of 0.1 mol/L citric acid buffer at pH 3.0. Liposome samples were prepared with the film dispersion method, and the pH value was adjusted to 7.5 through pH gradient active drug loading technology. The CLP-loaded liposomes obtained in this way had a rounded shape, good dispersity, an average particle size of (134.13±2.60) nm, polydispersity index (PDI) of 0.25±0.02, and a Zeta potential of (2.12±0.23) mV. The encapsulation efficiency was found to be (98.66±0.14)%, and the drug loading capacity was (7.47±0.01)%. The in vitro release results showed that 66.24% of CLP was released cumulatively within 72 h. Preliminary efficacy experiments showed that animals pretreated with CLP-loaded liposomes had lower serum levels of blood urea nitrogen and creatinine compared to the levels of IRI model rats without any pretreatment.Conclusion CLP-loaded liposomes were successfully prepared, which might provide the experimental foundation for the future development of CLP formulations for injection.
-
硫酸氢氯吡格雷(clopidogrel bisulfate, CLP)是一种具有二磷酸腺苷(adenosine diphosphate, ADP)受体拮抗作用的血小板聚集抑制剂,可以特异性抑制ADP诱导的血小板聚集。临床上,CLP多用于缺血性疾病高危患者,其疗效优于同类产品,安全性高,患者耐受性较好[1-2]。目前,常见CLP剂型为口服制剂[3],但口服制剂起效较注射剂慢,且口服剂型难以用于临床上无法完成吞咽的患者。因此,开发可注射的CLP剂型具有重要的临床意义。
CLP属于生物药剂学分类系统(Biopharmaceutics Classification System, BCS)Ⅱ类药物,溶解性较差、渗透性较好,故推测利用脂质体载药技术可以改善难溶性药物的溶解性,获得可供注射的CLP新剂型[4]。CLP是一种弱碱性药物,其pKa值约4.56,在中性pH条件下几乎不溶,而在pH=1左右较易溶解,pH=1时的平衡溶解度为944 mg/mL,在甲醇中易溶,在二氯甲烷中少量溶解,在乙醚中几乎不溶解[5]。因此,本研究拟采用脂质体包载技术提高CLP的溶解度,进而制备CLP静脉注射制剂。
脂质体常用的制备方法包括乙醇注入法、逆向蒸发法、乙醚注入法、pH梯度法、薄膜分散法、冻融法、超声分散法、冷冻干燥法等[6-7]。pH梯度主动载药技术利用药物在不同pH条件下荷电性差异进行载药,药物分子以电中性形式跨越脂质双层膜,而离子形式难以跨膜,故通过形成脂质体膜内、外水相pH值梯度,促使外水相药物自发向脂质体内部聚集,从而获得较高的包封率[8]。本研究考察pH梯度主动载药技术制备CLP脂质体,以包封率和粒径为指标通过单因素实验考察和正交实验确定最优处方和工艺,并对最优条件下制备的CLP脂质体的形态、粒径、包封率、载药量、Zeta电位、体外释药行为进行了全面考察,同时对CLP脂质体用于大鼠肾缺血再灌注损伤模型预处理的药效作用进行初步研究。
1. 材料与方法
1.1 材料
旋转蒸发仪(CCA-1111,Tokyo Rikakikai Co.,Ltd,日本);Zetasizer Nano ZS90型激光粒度及Zeta电位分析仪(Malvern,英国);PRACTUM221-1CN十万分之一电子天平(Sartorius,德国);JY96-Ⅱ超声波细胞粉碎机(宁波新艺超声设备有限公司,中国);PHS-3C pH计(上海仪电科学仪器股份有限公司,中国);H-600透射电镜(Hitachi公司,日本);CLP(白色或类白色结晶性粉末,批号:20171106,纯度:99.8%,合肥宏美双圣医药科技有限公司,中国);血生化仪Cobas C311(Roche,瑞士);蛋黄卵磷脂(egg phosphatidylcholine, EPC,批号:420K021,北京索莱宝科技有限公司,中国);胆固醇(批号:2017090601,成都市科隆化学品有限公司,中国);十八胺(octadecylamine, ODA,批号:M90108A,成都麦卡希化工有限公司,中国);聚乙二醇PEG400(polyethylene glycol 400, 批号:2017121201,成都市科隆化学品有限公司,中国);吐温-80(批号:C10260267,上海麦克林生化科技有限公司,中国);其余试剂购置于成都市科隆化学品有限公司,均为分析纯。
1.2 方法
1.2.1 CLP脂质体的制备
采用薄膜分散-探头超声法,并进行pH梯度主动载药制备CLP脂质体。称取处方量的EPC、胆固醇、ODA与PEG400置于50 mL茄形瓶中,用适量无水乙醇溶解,旋转减压蒸发除去无水乙醇,在瓶壁内形成均匀的脂质薄膜。加入5 mL预热的pH3.0柠檬酸钠缓冲液轻微震荡直至水化完全,探头冰浴超声,分别过0.8 μm滤膜和0.45 μm滤膜,得空白脂质体。加入用适量吐温-80助溶后的CLP溶液,用pH 11.45的碳酸钠调节pH为7.5,50 ℃水浴保温40 min,即得。
1.2.2 单因素考察确定制备CLP脂质体的最佳处方和制备工艺
以包封率和粒径为评价指标,对制备过程中的ODA用量(4、6、8、10、12 mg),PEG400用量(4、6、8、10、12 mg),EPC与胆固醇的质量比(2∶1、4∶1、8∶1)和药脂质量比(简称药脂比)(1∶5、1∶10、1∶20)进行考察,初步筛选出合适的处方;对制备过程中的孵育时间(10、20、30、40、60 min),孵育温度(30、40、50、60、70 ℃),pH梯度差(柠檬酸钠缓冲溶液固定内水相的pH值为3.0,以pH=11.45的碳酸钠溶液调节外水相的pH值至6.0、6.5、7.0、7.5)和超声条件(100 W,超5 s,间隔5 s,分别工作10次、20次、30次)进行考察,筛选出最佳的制备工艺。在单因素考察的基础上,以包封率为指标,对处方中药脂比(A)、胆固醇与EPC的质量比(B)、ODA的用量(C)、PGE400的用量(D)4个因素进行优选,以期得到包封率较高的脂质体处方。筛选出最佳处方和最佳工艺后平行制备3批脂质体进行处方和工艺的验证。尝试采用微柱离心法和超滤离心法测定脂质体的包封率,实验最终采用超滤离心法(滤膜截留相对分子质量为50×103,容量为5 mL),离心力3000×g,离心时间1 h,除去未包载的CLP。以体积分数15%乙醇溶液作为游离药物溶剂,用甲醇破乳测定制剂中CLP的总含量。使用高效液相色谱法(high performance liquid chromatography, HPLC)测定药物含量,计算CLP脂质体的包封率和载药量:包封率=(W总−W游)/W总×100%;W总为制剂中CLP的总含量,W游为未包入脂质体的游离药量;载药量=We/Wm×100%,式中We表示包封于脂质体内的药量,Wm表示载药脂质体的总质量;色谱条件为Kromasil C18色谱柱(4.6 mm×250 mm,5 μm),流动相为体积比为甲醇∶水∶三乙胺(800∶200∶2)的三元体系(磷酸溶液调pH至3.6~3.8),流速为1.0 mL/min,柱温为35 ℃,检测波长为270 nm,进样量为20 μL。通过激光散射粒度仪测定CLP脂质体的平均粒径。根据实验结果,确定最佳处方和最佳工艺。
1.2.3 CLP脂质体的制剂学表征和体外释放行为考察
采用最佳工艺和处方制备CLP脂质体,并对其制剂学性质进行表征。用双蒸水稀释至适当浓度,采用激光散射粒度仪测定CLP脂质体的粒径分布和采用透射电镜观察CLP脂质体的形态,将CLP脂质体滴于铜网,采用磷钨酸染色,然后置于透射电镜下观察纳米粒的形态。采用透析法测定CLP脂质体的体外释放行为:取CLP脂质体溶液5 mL,置透析袋中,将透析袋置50 mL透析介质(1.0%吐温-80-PBS)中,再将上述溶液置37 ℃水浴中,磁力搅拌(200 r/min),分别于0.5、1、2、3、5、7、9、12、23、29、32、48、58、72 h时取1 mL渗出液,同时补充1 mL原液。将取出的1 mL渗出液进行高效液相分析,并计算药物释放量。CLP的累积释放率(Q)按下式计算[9]:
$$ {{Q}} = \frac{{{{{C}}_{{n}}}{{V}} + \displaystyle\sum\nolimits_{{{i}} = 1}^{{{n}} - 1} {{{{C}}_{{i}}}} {{{V}}_{{i}}}}}{{{m}}} \times 100\% {\text{ 。}} $$ 上式中:Ci和Cn分别表示第i次和第n次取样时,释放介质中CLP的浓度;V表示释放介质的总体积(50 mL);Vi表示第i次的取样体积(1 mL);m表示样品中CLP的总质量。
1.2.4 CLP脂质体对大鼠肾缺血再灌注损伤的影响
健康的雄性SD大鼠(220~240 g),购于成都达硕生物科技有限公司。动物饲养条件:温度24~26 ℃,湿度45%~55%,标准饲料喂养,自由饮水与进食。动物实验过程遵循我国《实验动物福利伦理审查指南(GB/T 35892-2018)》提出的原则与要求。9只大鼠随机分为正常组、造模组和治疗组,每组3只。正常组和造模组术前24 h尾静脉注射与治疗组相同体积的生理盐水,治疗组术前24 h按照CLP剂量6 mg/kg进行尾静脉注射给药。手术程序:大鼠术前禁食8~12 h,10%水合氯醛(4.5 mL/kg)腹腔注射麻醉;从大鼠背部切口(大鼠肋骨往下划开约3 cm即可找到肾脏),用钝性镊子和棉签轻轻将肾脏和背部的脂肪分离,即可看到大鼠的动静脉,用无损伤血管夹夹闭肾动静脉45 min,见肾脏由红润渐转为暗褐色,缺血后去除血管夹使肾脏血液再灌注;术后大鼠于(24±2) ℃的环境保暖,补充水与饲料[10-12]。肾脏灌注后24 h,经眼眶内眦静脉丛取血0.3~0.5 mL,8000 r/min 10 min离心后吸取血清,检测血清肌酐(creatinine, CREA)和尿素氮(blood urea nitrogen, BUN)水平。
1.2.5 统计学方法
组间比较采用t检验,P<0.05为差异有统计学意义。
2. 结果
2.1 单因素筛选处方
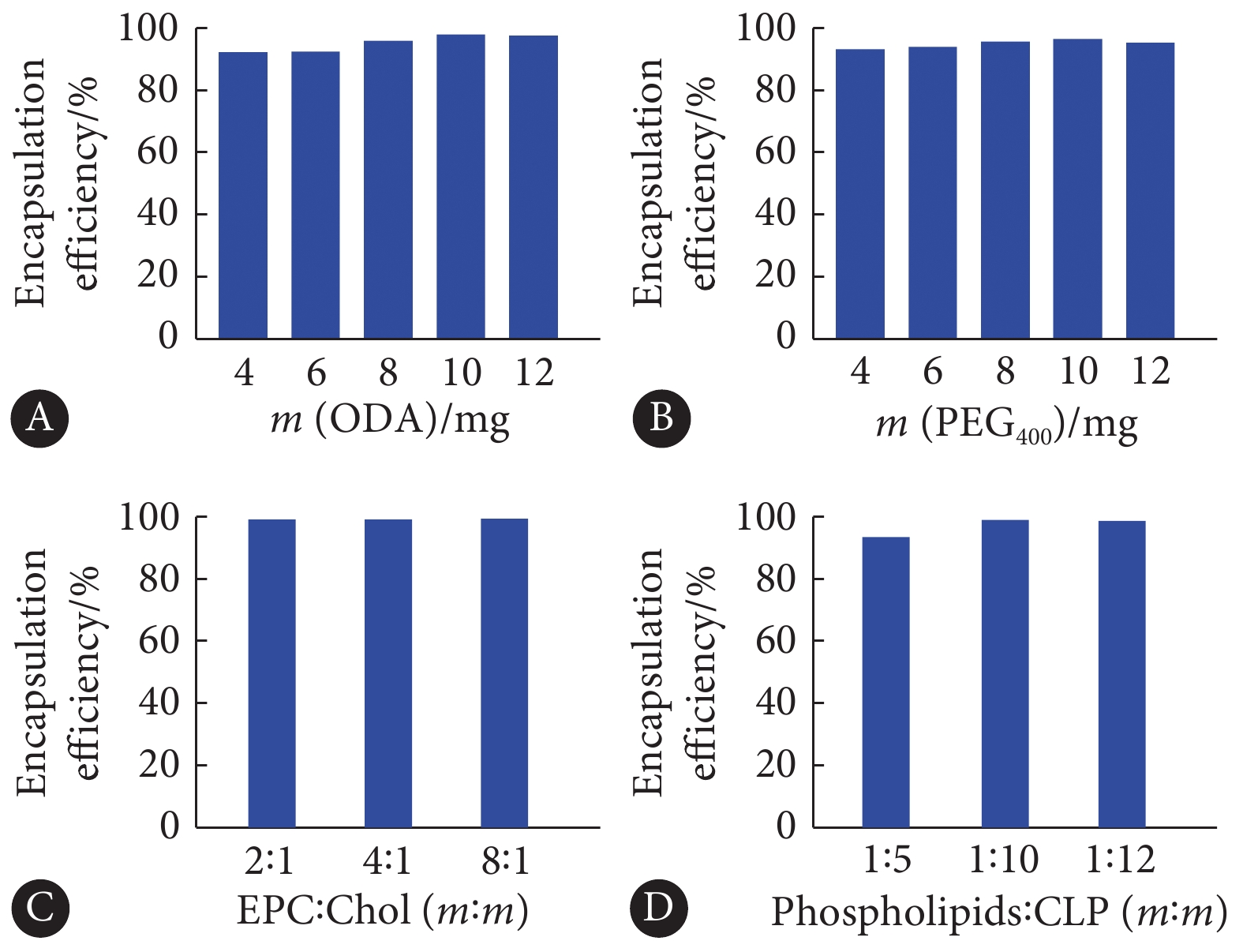
ODA和PEG400的用量为4、6、8、10、12 mg时制备脂质体,如图1A、1B所示,随着用量的增加,包封率呈逐渐增加再减小的趋势,因此拟定ODA和PEG400的用量为10 mg;EPC与胆固醇的质量比为2∶1、4∶1、8∶1时制备脂质体,如图1C所示,随着比例的增加,包封率变化不明显,故折中拟定EPC与胆固醇的质量比为4∶1;药脂比为1∶5、1∶10、1∶20时制备脂质体,如图1D所示,随着比例的增加,包封率呈逐渐增加再减小的趋势,因此拟定药脂比为1∶10。
2.2 制备工艺的筛选
2.2.1 孵育时间
由表1可见,随着孵育时间的增加,包封率先增加后减小,但对粒径、多分散指数(polydispersity index, PDI)和电位的影响不大,故选择孵育时间为40 min。
表 1 孵育时间对粒径、PDI、电位和包封率的影响(n=1)Table 1. Effect of incubation time on particle size, PDI, Zeta potential and encapsulation efficiency (n=1)Incubation time/min Size/nm PDI Zeta potential/mV EE/% 10 168.7 0.213 2.23 93.13 20 162.1 0.167 2.03 94.75 30 155.3 0.119 1.73 95.73 40 158.8 0.167 2.03 96.00 60 156.8 0.187 2.30 94.99 PDI: Polydispersity index; EE: Encapsulation efficiency. 2.2.2 孵育温度
随着孵育温度的增加,包封率先增加后减小,但对粒径、PDI和电位的影响不大,故选择孵育温度为50 ℃,结果见表2。
表 2 孵育温度对粒径、PDI、电位和包封率的影响(n=1)Table 2. Effect of incubation temperature on particle size, PDI, Zeta potential and encapsulation efficiency (n=1)Incubation
temperature/℃Size/nm PDI Zeta
potential/mVEE/% 30 157.2 0.143 2.86 92.55 40 150.5 0.053 3.47 94.86 50 159.3 0.122 3.17 95.62 60 159.8 0.127 2.23 94.88 70 158.7 0.112 3.85 91.98 PDI: Polydispersity index; EE: Encapsulation efficiency. 2.2.3 不同的pH梯度差
pH梯度法制备脂质体,跨膜pH梯度是影响包封率最主要的因素。随着pH梯度的增加,包封率呈逐渐上升的趋势,但对粒径、PDI和电位的影响不大,故选择pH梯度差为4.5,结果见表3。
表 3 不同pH梯度对粒径、PDI、电位和包封率的影响(n=1)Table 3. Effect of pH gradient on particle size, PDI, Zeta potential and encapsulation efficiency (n=1)pH adjustment Size/nm PDI Zeta potential/mV EE/% Inner water phase (pH3.0) Outer water phase (pH6.0) 200.7 0.074 3.34 91.83 Outer water phase (pH6.5) 160.8 0.033 2.51 94.24 Outer water phase (pH7.0) 160.8 0.105 2.35 95.94 Outer water phase (pH7.5) 167.0 0.375 2.30 96.05 PDI: Polydispersity index; EE: Encapsulation efficiency. 2.2.4 超声条件的筛选
由表4可见,随着超声时间的延长,脂质体的粒径和PDI逐渐减小,因100 W、超声5 s、间隔5 s、工作20次的超声条件得到的脂质体已经满足实验的要求,以节约成本的原则选择此超声条件进行脂质体的制备。
表 4 超声条件对粒径和PDI的影响(n=1)Table 4. Effect of ultrasound conditions on particle size and PDI (n=1)Number Size/nm PDI 1 137.4 0.227 2 118.6 0.218 3 109.4 0.206 1: Ultrasonication (efficiency, 100 W, 10 times at 5 s interval); 2: Ultrasonication (efficiency, 100 W, 20 times at 5 s interval); 3: Ultrasonication (efficiency, 100 W, 30 times at 5 s interval); PDI: Polydispersity index. 2.3 正交设计筛选出最佳处方
根据单因素实验的结果选取恰当的水平,用L9(34)正交实验法优化工艺处方,因素水平表及实验结果见表5和表6。
表 5 因素-水平表Table 5. Factors and levelsLevel Factor A
(CLP∶phospholipid)B
(EPC∶Chol)C
(ODA/mg)D
(PEG400/mg)1 1∶9 4∶1 8 8 2 1∶10 6∶1 10 10 3 1∶11 8∶1 12 12 CLP: Clopidogrel bisulfate; EPC: Egg phosphatidyl choline; ODA: Octadecylamine. 表 6 正交实验结果及分析(n=1)Table 6. Results and analysis of orthogonal test (n=1)Level Factor EE/% A
(CLP∶phospholipid)B
(EPC∶Chol)C
(ODA/mg)D
(PEG400/mg)1 1∶9 4∶1 8 8 96.79 2 1∶9 6∶1 10 10 98.48 3 1∶9 8∶1 12 12 97.05 4 1∶10 4∶1 10 12 98.73 5 1∶10 6∶1 12 8 98.81 6 1∶10 8∶1 8 10 97.06 7 1∶11 4∶1 12 10 99.19 8 1∶11 6∶1 8 12 98.32 9 1∶11 8∶1 10 8 95.97 K1 292.32 294.71 292.17 291.57 K2 294.60 295.61 293.18 294.73 K3 293.48 290.08 295.05 294.10 R 0.76 0.30 0.96 1.05 K1, K2, and K3 are the sum of the three levels of encapsulation efficiency for each factor; R: Extreme value; EE: Encapsulation efficiency. A-D: The alphabets denote the same terms as those in table 5. 通过对正交实验进行极差分析可知,各因素对包封率影响的顺序为D>C>A>B。分析得出最优化组合为A2B2C3D2,即药脂比为1∶10,EPC与胆固醇质量比为6∶1,ODA与药物的质量比为1.2∶1,PEG400与药物的质量比为1∶1。
2.4 最佳处方和工艺的验证
按照最佳处方和最佳工艺的筛选结果,平行制备3批脂质体,测定其粒径、PDI、包封率和载药量,结果见表7。
表 7 最佳处方和工艺验证结果(n=3)Table 7. Verified results of optimal formulation and technology (n=3)Number Size/nm PDI Zeta potential/mV EE/% DL/% 1 131.6 0.235 2.35 98.81 7.48 2 134.0 0.238 2.12 98.54 7.47 3 136.8 0.272 1.90 98.63 7.47 PDI: Polydispersity index; EE: Encapsulation efficiency; DL: Drug loading. 由实验结果可知,平均粒径为(134.13±2.60) nm,平均电位为(2.12±0.23) mV,平均PDI为0.25±0.02,平均包封率为(98.66±0.14)%,平均载药量为(7.47±0.01)%,该处方和工艺稳定,可重现。
2.5 最佳处方和工艺下制备的CLP脂质体的表征
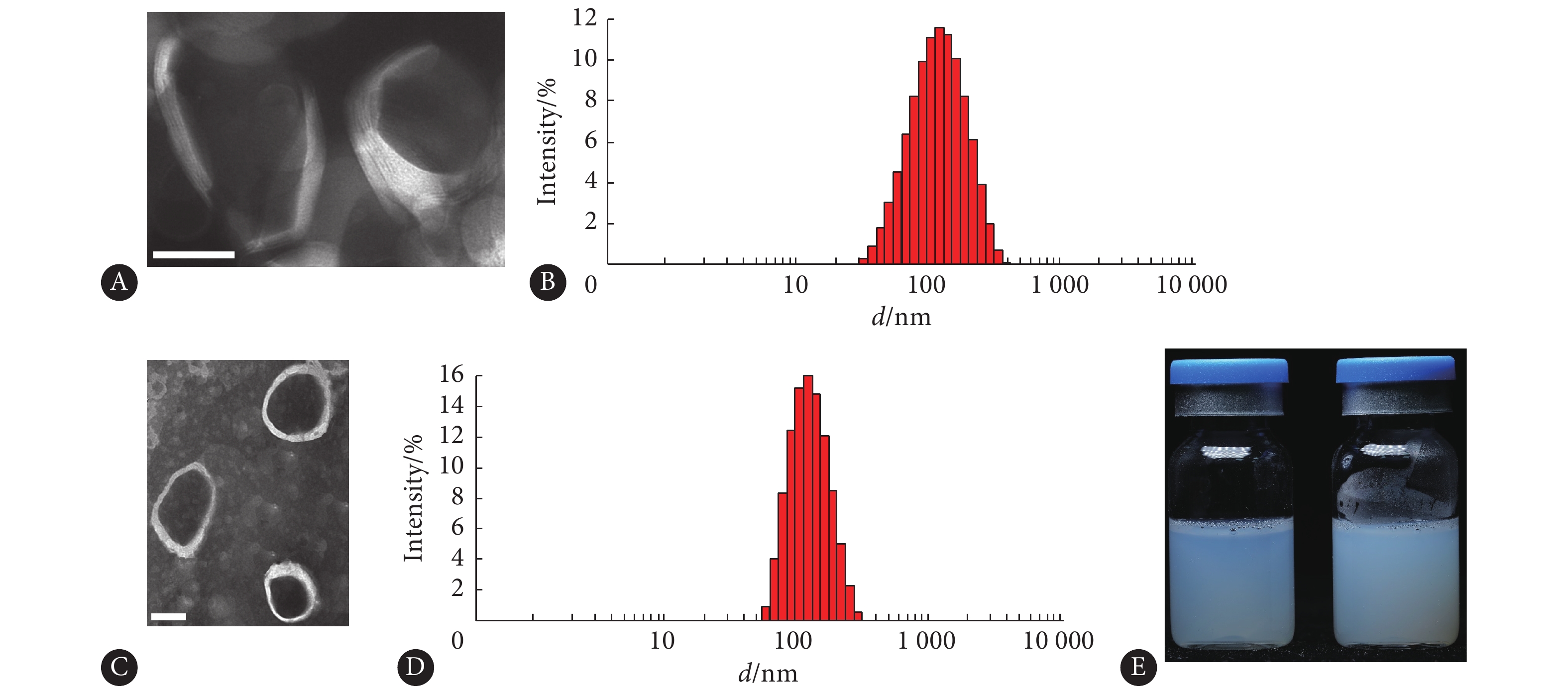
采用透射电镜观察空白脂质体和CLP脂质体的形态,结果显示(图2A、2C),外观形貌呈较规则球状,分散性好,呈双分子结构,采用激光散射粒径分析仪测定空白脂质体和CLP脂质体的粒径分布,结果显示空白脂质体和CLP脂质体的粒径呈现单峰分布,平均粒径为130 nm(图2B、2D),粒径大小与透射电镜观察结果基本一致。空白脂质体和CLP脂质体的外观呈牛奶状,泛蔚蓝色的乳光(图2E)。
![]() 图 2 空白脂质体的透射电镜图和粒径分布图(A、B),CLP脂质体的透射电镜和粒径分布(C、D),空白脂质体(E,左)和CLP脂质体(E,右)的外观图(比例尺:100 nm)Figure 2. Characterization of blank liposomes: Transmission electron microscope (TEM) image (A), and size distributions (B); Characterization of CLP-loaded liposomes: TEM image (C), size distributions (D); Appearance of blank liposomes (left) and CLP-loaded liposomes (right) (E) (scale bars=100 nm)
图 2 空白脂质体的透射电镜图和粒径分布图(A、B),CLP脂质体的透射电镜和粒径分布(C、D),空白脂质体(E,左)和CLP脂质体(E,右)的外观图(比例尺:100 nm)Figure 2. Characterization of blank liposomes: Transmission electron microscope (TEM) image (A), and size distributions (B); Characterization of CLP-loaded liposomes: TEM image (C), size distributions (D); Appearance of blank liposomes (left) and CLP-loaded liposomes (right) (E) (scale bars=100 nm)2.6 体外释放实验结果
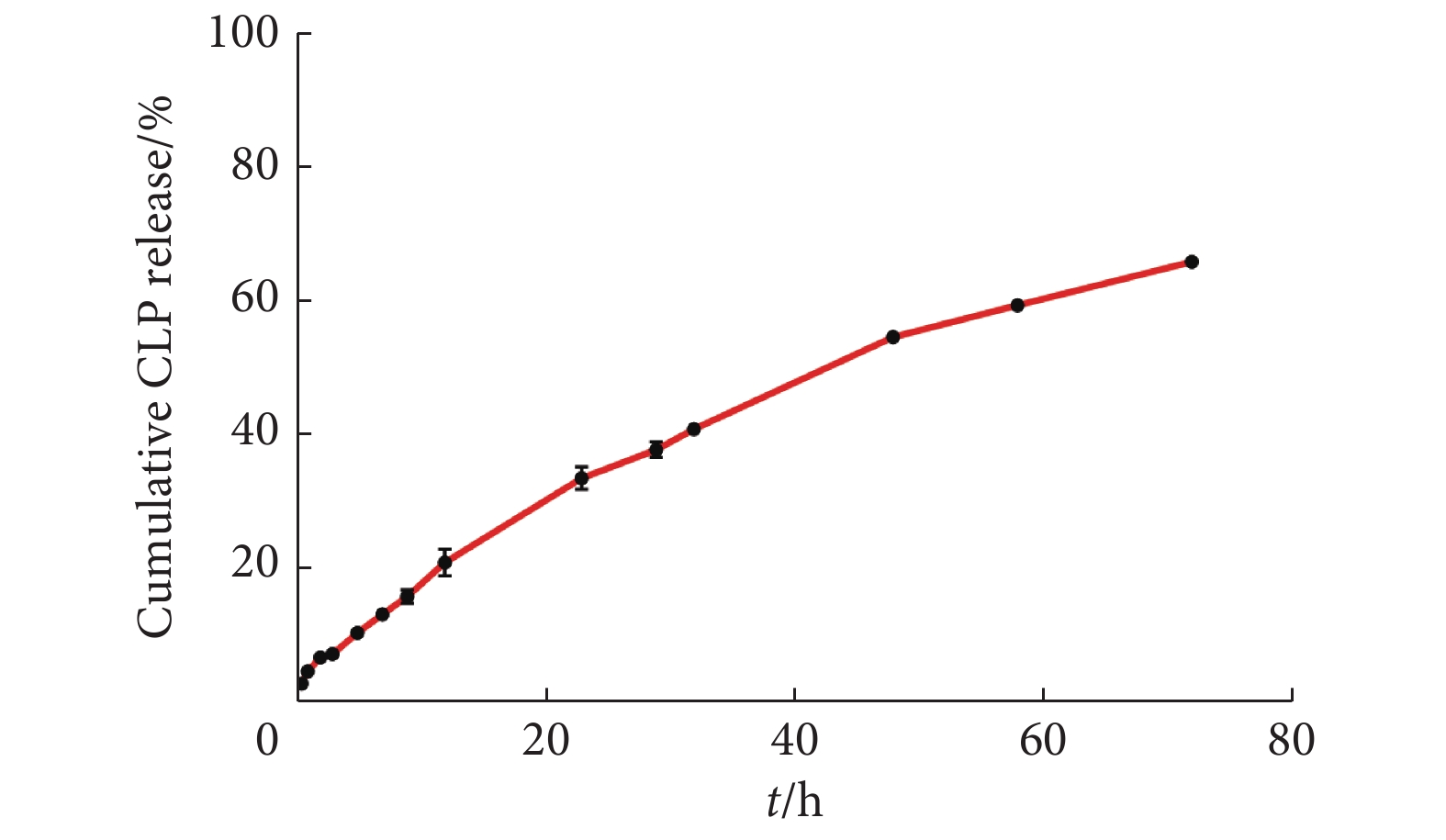
如图3所示,前3 h CLP的释放率仅为7.62%,12 h内脂质体包埋的CLP释放率仅为21.26%,72 h内脂质体包埋的CLP释放率为66.24%。由此可见,CLP脂质体表现出持续的释放特性。
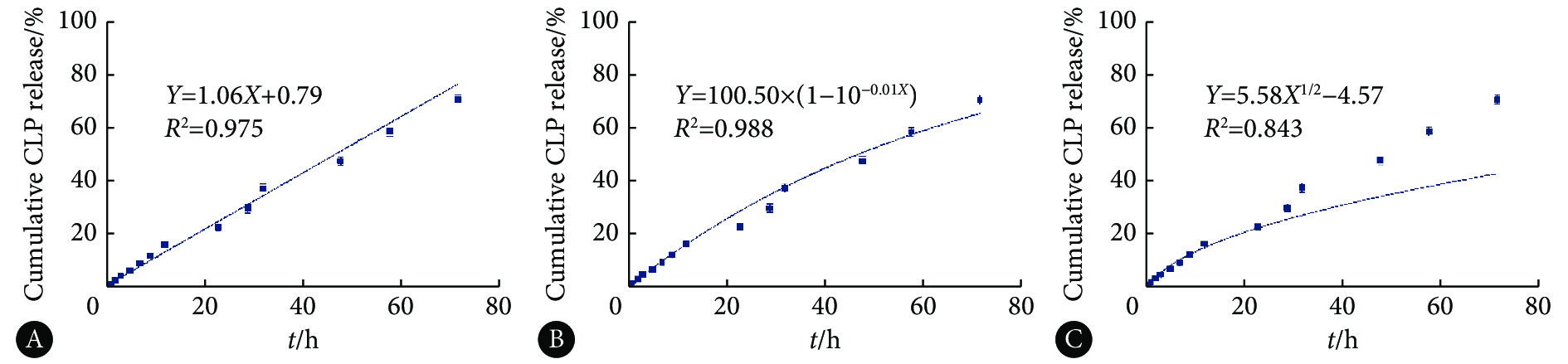
将脂质体中药物释放情况进行动力学模型拟合可以在一定程度上反映药物的释放机理。因此,使用Origin 2018软件对本实验中的体外释放数据进行零级释放模型、一级释放模型、Higuchi模型拟合,根据拟合优度(R2)来判定曲线拟合情况。如图4所示,CLP脂质体体外释放数据对一级释放模型拟合较好(R2=0.988)。
2.7 CLP脂质体预处理对大鼠肾缺血再灌注损伤保护的影响
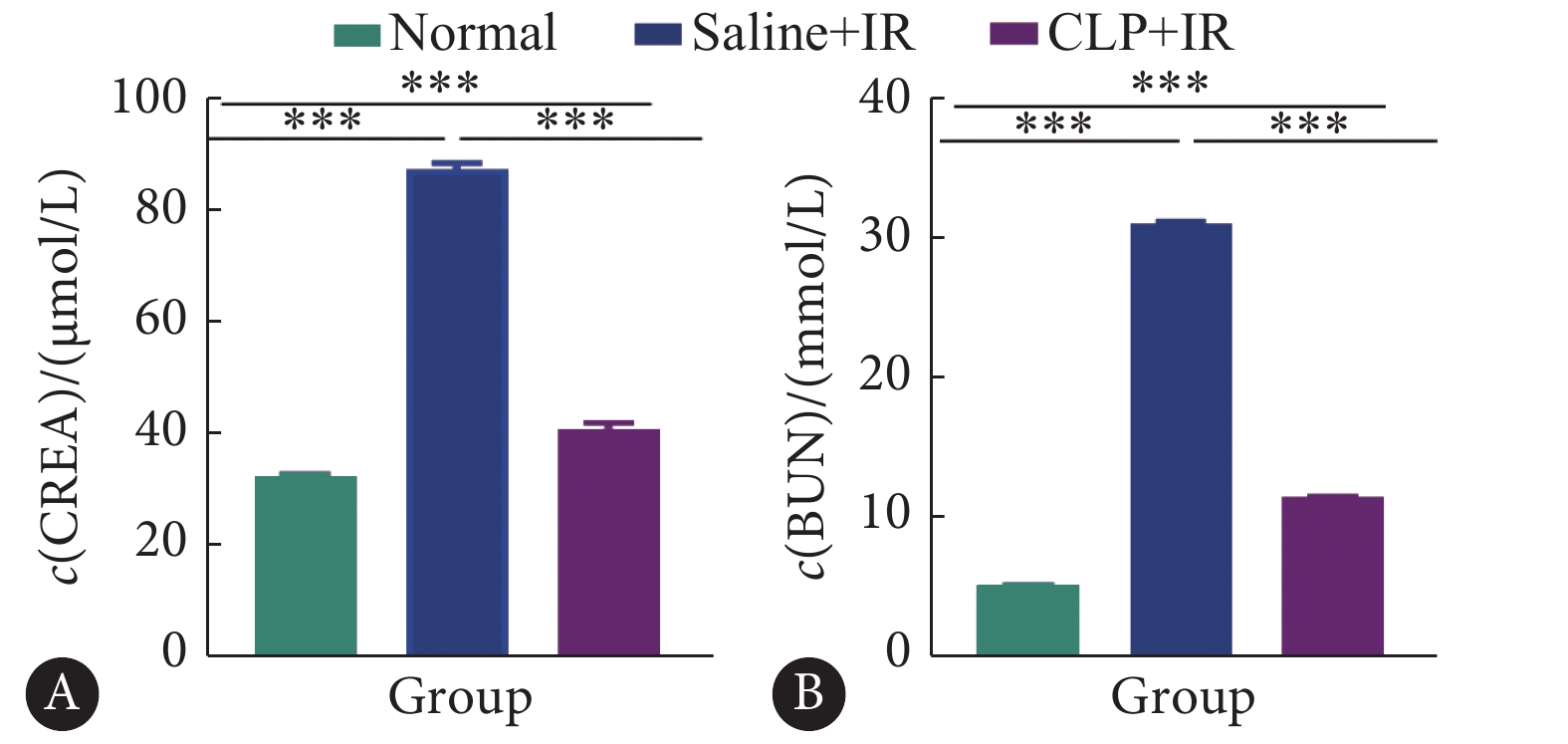
结果如图5所示,I/R造模成功后,血清CREA和BUN的数值较正常组升高(P<0.0001),表明肾脏的损伤严重。同时,治疗组血清CREA和BUN水平较造模组低(P<0.001),初步表明CLP对大鼠肾脏缺血再灌注损伤有较好的保护和缓解损伤的作用。
3. 讨论
本研究最初比较了薄膜分散法、逆相蒸发法和pH梯度法3种制备工艺,所得脂质体的包封率为pH梯度法>薄膜分散法>逆相蒸发法,且pH梯度法制备的脂质体粒径更均一,因此实验最终选取了pH梯度法进行脂质体的制备。结果显示,随着孵育时间和孵育温度的增加,脂质体的包封率呈先增加后减小的趋势,因此实验选择了孵育时间40 min、孵育温度为50 ℃进行脂质体的制备。随着pH梯度差越大,脂质体的包封率呈逐渐升高的趋势,但是磷脂在中性的环境下较稳定,因此,选择外水相的pH值为7.5,内外水相pH梯度差为4.5。
pH梯度法适用于制备弱酸或弱碱性的水溶性药物,其能提高药物包封率的原理为:若药物为弱酸性,选择内水相为高pH、外水相为低pH的梯度差,弱酸性药物在外水相中以分子态存在,随着药物分子在内外水相中的流动,进入内水相的药物分子被内水相中的碱性溶液中和,形成离子态药物,从而存在于内水相中不再流动达到包封的效果。反之,若待包封的药物为弱碱性,则选择外高内低的pH梯度差[13]。由于CLP为弱碱性药物,则选取内水相为低pH、外水相为高pH的梯度差制备CLP脂质体。
脂质体包封率是重要的评价指标。目前,包封率的测定方法主要有透析法、离心法、超滤离心法、葡聚糖凝胶法等。其中,超滤离心法操作简单,分离快速,广泛应用于水溶性药物脂质体包封率的测定,但鲜有应用于难溶药物包封率检测[14]。本研究曾尝试采用微柱离心法,葡聚糖凝胶柱与离心分离结合可以快速分离脂质体和游离药物[15-16],葡聚糖凝胶柱用Sephadex G-50填充,2000 r/min离心4 min,重复操作3次,但在实验中测定微型离心柱对空白脂质体的吸附作用,平均回收率为(104.94±3.20)%,相对标准偏差(RSD)为3.05%,表明该方法的重复性不好,不适于测定脂质体的包封率。本研究将高效液相色谱分析技术与超滤离心法相结合,以15%的乙醇溶液作为游离药物溶剂,应用该方法检测CLP脂质体的包封率。15%的乙醇溶液能将游离的疏水性药物完全溶解,且又在平衡时间内不会造成脂质体的渗漏[17]。经实验证实15%的乙醇溶液对CLP低(49.04 μg/mL)、中(306.5 μg/mL)、高(613 μg/mL)质量浓度的回收率分别为(95.62±1.34)%、(94.22±0.25)%、(91.46±1.21)%,RSD分别为1.41%、0.27%、1.33%。照中国药典2015版第4部通则 3103中描述的磷测定法建立磷标准曲线,以磷含量(μg)为横坐标,紫外吸光度为纵坐标,其公式为Y=0.047 4X+0.016,R2=0.999 7,磷含量和紫外吸光度在0.114~0.493 µg的范围内线性关系良好。制备空白脂质体,分别用15%的乙醇溶液和纯水稀释5倍,吸取1 mL稀释后的溶液于超滤管中,超滤离心(3 000×g,1 h),取滤液做定磷法,测定结果表明滤液中几乎不含磷脂,表明超滤膜能够很好地截留空白脂质体,而且15%的乙醇溶液不会破坏脂质体,造成脂质体的渗漏。因此,本实验以15%的乙醇溶液作为游离药物溶剂,应用高效液相色谱分析技术与超滤离心法相结合检测CLP脂质体的包封率。
处方中添加ODA,可以调节电荷使脂质体带上正电荷,其次ODA可以提高脂质体的包封率和稳定性[18]。实验结果表明制备的脂质体为正电荷脂质体,包封率较高。PEG400作为注射剂中的增溶剂。吐温-80对CLP起到助溶作用,使CLP较容易进入脂质体内水相,起到稳定的作用。卵磷脂在广义范围上指的是由磷脂酰胆碱(PC)、磷脂酰乙醇胺(PE)、磷脂酰丝氨酸(PS)、磷脂酰肌醇(PI)和磷脂酸(PA)等组成的磷脂混合物。EPC中主要含有PC和PE两种活性组分,其中PC约占总卵磷脂含量的80%,是大豆卵磷脂的3倍,另一种主要的成分PE,占总量的18%。由于EPC中几乎不含有PI、PS和PA,从蛋黄中提取得到卵磷脂的产品纯度高[19]。EPC的氧化指数和不饱和度低于大豆卵磷脂,卵磷脂的不饱和程度越高,卵磷脂分子的反式构象增加,构成脂质体双脂层的卵磷脂分子之间的排列越疏松,脂质体囊泡越容易变形[20]。且EPC能溶于无水乙醇,无水乙醇的毒性相对较低,因此选择EPC作为成膜材料。
CLP脂质体的体外释放实验中表现出持续的释放特性,原因可能是很大一部分的CLP被包裹在脂质体的水相里,构成脂质体的磷脂双分子层的阻碍,抑制了CLP从磷脂双分子层爆发性地释放出来,使得CLP缓慢释放。
综上,本研究通过筛选不同处方和不同制备工艺对CLP脂质体粒径和包封率的影响,确定了其最优处方和工艺,最终获得了CLP脂质体纳米制剂,其粒径、包封率、载药量、体外释放行为和初步药效实验均符合预期,但本研究仍存在不足,CLP在水溶液中的溶解度较低,无法制备成游离的CLP与CLP脂质体作比较,且CLP对肾缺血再灌注损伤的保护作用机制尚不明确,还需深入研究。
* * *
利益冲突 所有作者均声明不存在利益冲突
-
图 2 空白脂质体的透射电镜图和粒径分布图(A、B),CLP脂质体的透射电镜和粒径分布(C、D),空白脂质体(E,左)和CLP脂质体(E,右)的外观图(比例尺:100 nm)
Figure 2. Characterization of blank liposomes: Transmission electron microscope (TEM) image (A), and size distributions (B); Characterization of CLP-loaded liposomes: TEM image (C), size distributions (D); Appearance of blank liposomes (left) and CLP-loaded liposomes (right) (E) (scale bars=100 nm)
表 1 孵育时间对粒径、PDI、电位和包封率的影响(n=1)
Table 1 Effect of incubation time on particle size, PDI, Zeta potential and encapsulation efficiency (n=1)
Incubation time/min Size/nm PDI Zeta potential/mV EE/% 10 168.7 0.213 2.23 93.13 20 162.1 0.167 2.03 94.75 30 155.3 0.119 1.73 95.73 40 158.8 0.167 2.03 96.00 60 156.8 0.187 2.30 94.99 PDI: Polydispersity index; EE: Encapsulation efficiency. 表 2 孵育温度对粒径、PDI、电位和包封率的影响(n=1)
Table 2 Effect of incubation temperature on particle size, PDI, Zeta potential and encapsulation efficiency (n=1)
Incubation
temperature/℃Size/nm PDI Zeta
potential/mVEE/% 30 157.2 0.143 2.86 92.55 40 150.5 0.053 3.47 94.86 50 159.3 0.122 3.17 95.62 60 159.8 0.127 2.23 94.88 70 158.7 0.112 3.85 91.98 PDI: Polydispersity index; EE: Encapsulation efficiency. 表 3 不同pH梯度对粒径、PDI、电位和包封率的影响(n=1)
Table 3 Effect of pH gradient on particle size, PDI, Zeta potential and encapsulation efficiency (n=1)
pH adjustment Size/nm PDI Zeta potential/mV EE/% Inner water phase (pH3.0) Outer water phase (pH6.0) 200.7 0.074 3.34 91.83 Outer water phase (pH6.5) 160.8 0.033 2.51 94.24 Outer water phase (pH7.0) 160.8 0.105 2.35 95.94 Outer water phase (pH7.5) 167.0 0.375 2.30 96.05 PDI: Polydispersity index; EE: Encapsulation efficiency. 表 4 超声条件对粒径和PDI的影响(n=1)
Table 4 Effect of ultrasound conditions on particle size and PDI (n=1)
Number Size/nm PDI 1 137.4 0.227 2 118.6 0.218 3 109.4 0.206 1: Ultrasonication (efficiency, 100 W, 10 times at 5 s interval); 2: Ultrasonication (efficiency, 100 W, 20 times at 5 s interval); 3: Ultrasonication (efficiency, 100 W, 30 times at 5 s interval); PDI: Polydispersity index. 表 5 因素-水平表
Table 5 Factors and levels
Level Factor A
(CLP∶phospholipid)B
(EPC∶Chol)C
(ODA/mg)D
(PEG400/mg)1 1∶9 4∶1 8 8 2 1∶10 6∶1 10 10 3 1∶11 8∶1 12 12 CLP: Clopidogrel bisulfate; EPC: Egg phosphatidyl choline; ODA: Octadecylamine. 表 6 正交实验结果及分析(n=1)
Table 6 Results and analysis of orthogonal test (n=1)
Level Factor EE/% A
(CLP∶phospholipid)B
(EPC∶Chol)C
(ODA/mg)D
(PEG400/mg)1 1∶9 4∶1 8 8 96.79 2 1∶9 6∶1 10 10 98.48 3 1∶9 8∶1 12 12 97.05 4 1∶10 4∶1 10 12 98.73 5 1∶10 6∶1 12 8 98.81 6 1∶10 8∶1 8 10 97.06 7 1∶11 4∶1 12 10 99.19 8 1∶11 6∶1 8 12 98.32 9 1∶11 8∶1 10 8 95.97 K1 292.32 294.71 292.17 291.57 K2 294.60 295.61 293.18 294.73 K3 293.48 290.08 295.05 294.10 R 0.76 0.30 0.96 1.05 K1, K2, and K3 are the sum of the three levels of encapsulation efficiency for each factor; R: Extreme value; EE: Encapsulation efficiency. A-D: The alphabets denote the same terms as those in table 5. 表 7 最佳处方和工艺验证结果(n=3)
Table 7 Verified results of optimal formulation and technology (n=3)
Number Size/nm PDI Zeta potential/mV EE/% DL/% 1 131.6 0.235 2.35 98.81 7.48 2 134.0 0.238 2.12 98.54 7.47 3 136.8 0.272 1.90 98.63 7.47 PDI: Polydispersity index; EE: Encapsulation efficiency; DL: Drug loading. -
[1] 陶灵刚. 硫酸氢氯吡格雷脂质体固体制剂: CN102397253A. 2012-04-04 [2019-06-01]. https://kns.cnki.net/kcms/detail/detail.aspx?FileName=CN102397253A&DbName=SCPD2012. [2] 路光明. 硫酸氢氯吡格雷片剂的研制. 济南: 齐鲁工业大学, 2019. [3] SEO K S, HAN H K. Multilayer-coated tablet of clopidogrel and rosuvastatin: Preparation and in vitro/in vivo characterization. Pharmaceutics,2019,11(7): 313. DOI: 10.3390/pharmaceutics11070313
[4] FANG Y P, CHUANG C H, WU Y J, et al. SN38-loaded < 100 nm targeted liposomes for improving poor solubility and minimizing burst release and toxicity: in vitro and in vivo study. Int J Nanomedicine,2018,13: 2789–2802. DOI: 10.2147/IJN.S158426
[5] SHAH H P, PRAJAPATI S T. Quality by design based development and optimization of novel gastroretentive floating osmotic capsules of clopidogrel bisulfate. J Pharm Investig,2019,49(3): 295–311. DOI: 10.1007/s40005-018-0405-5
[6] 晏斐,郭悦平,于佳岐,等. α-生育酚脂质体的制备及初步性质评价. 中国药师,2021,24(4): 745–750. [7] MOZAFARI M R. Liposomes: An overview of manufacturing techniques. Cell Mol Biol Lett,2005,10(4): 711–719.
[8] 郑杭生, 黄绳武, 李范珠, 等. 盐酸青藤碱脂质体的制备工艺研究. 中草药,2013,44(4): 408–413. [9] 余荧蓝, 郑智元, 伊宸辰, 等. 青蒿素长循环脂质体的制备及体外性质评价. 药学学报,2018,53(6): 1002–1008. [10] HU X, JIA M, FU Y, et al. Novel low-toxic derivative of celastrol maintains protective effect against acute renal injury. ACS Omega,2018,3(3): 2652–2660. DOI: 10.1021/acsomega.7b01890
[11] WEI Q, DONG Z. Mouse model of ischemic acute kidney injury: technical notes and tricks. Am J Physiol Renal Physiol,2012,303(11): F1487–F1494. DOI: 10.1152/ajprenal.00352.2012
[12] HU H, WANG G, BATTEUX F, et al. Gender differences in the susceptibility to renal ischemia-reperfusion injury in BALB/c mice. Tohoku J Exp Med,2009,218(4): 325–329. DOI: 10.1620/tjem.218.325
[13] 刘力铭. 脂质体制备工艺及处方的优化筛选. 青岛: 青岛科技大学, 2015. [14] 隋小宇, 李娟, 翟伟宇, 等. 超滤法测定甘草次酸脂质体包封率. 中成药,2018,40(2): 478–480. DOI: 10.3969/j.issn.1001-1528.2018.02.049 [15] 吕晓燕, 尹君婧, 杨秀成, 等. 用于治疗非小细胞肺癌的阿法替尼脂质体的制备与包封率的测定. 中国肺癌杂志,2018,21(9): 663–669. DOI: 10.3779/j.issn.1009-3419.2018.09.02 [16] WANG S, LIU C, WANG C, et al. Arsenic trioxide encapsulated liposomes prepared via copper acetate gradient loading method and its antitumor efficiency. Asian J Pharm Sci,2020,15(3): 365–373. DOI: 10.1016/j.ajps.2018.12.002
[17] 张伟光, 高树刚, 安红. 大豆磷脂阿奇霉素脂质体的制备及包封率测定. 精细化工,2008(4): 369–371. DOI: 10.3321/j.issn:1003-5214.2008.04.015 [18] 陈静怡, 任翔, 王晓辉, 等. 积雪草苷修饰脂质体在大鼠体内的药动学及组织分布研究. 中草药,2017,48(21): 4419–4424. DOI: 10.7501/j.issn.0253-2670.2017.21.009 [19] 陈晋. 蛋黄卵磷脂活性组分的分离纯化及其辅助增强记忆功能研究. 大连: 大连工业大学, 2019. [20] 王继波, 孙衍增. 脂质体载药性能与卵磷脂的关系. 精细化工,2008,25(3): 256–259. DOI: 10.3321/j.issn:1003-5214.2008.03.012 -
期刊类型引用(2)
1. 赵慧凤,韩露,张灵怡,李珊珊,杨可. 脂质体的制备方法研究进展. 生物化工. 2025(02): 243-247 .  百度学术
百度学术
2. 王海英,赵体英,王恒,蒋琼. 瑞舒伐他汀强化疗法联合双抗疗法治疗短暂性脑缺血发作患者疗效分析. 实用医院临床杂志. 2023(04): 137-141 .  百度学术
百度学术
其他类型引用(3)

 首页
首页


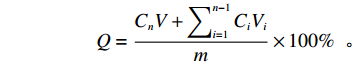
 下载:
下载: