Endoplasmic Reticulum Stress and Mitochondrial Damage in Rat Cardiomyocytes after Acute Myocardial Infarction
-
摘要:目的 探究急性心肌梗死后心肌细胞内质网应激反应与线粒体损伤的变化趋势,以期进一步了解急性心肌梗死后心肌细胞损伤的具体机制。方法 32只SD大鼠建立急性心肌梗死大鼠模型,分别在造模后1 h 、2 h 、4 h和6 h时各处死8只大鼠,收集心肌组织;对照组(n=8)除未结扎心脏左冠状动脉前降支主干外,余处理均同模型组,处理后6 h时收集心肌组织。通过荧光定量PCR技术检测心肌细胞中激活转录因子6(activating transcription factor 6,ATF6)、免疫球蛋白重链结合蛋白(immunoglobulin heavy chain binding potein,BiP)的mRNA水平和线粒体DNA水平,采用试剂盒检测心肌细胞ATP水平。结果 ATF6和BiP的mRNA水平在急性心肌梗死后1 h即出现明显升高,并在2 h及以后维持在较高水平(P<0.05)。心肌细胞ATP水平在急性缺血2 h时出现明显升高,而在4 h及以后出现下降,并低于正常水平(P<0.05)。心肌细胞细胞质中线粒体DNA水平在急性心肌梗死2 h后开始出现明显升高,在4 h和6 h时持续升高(P<0.05)。结论 急性心肌梗死后线粒体的损伤可能继发于内质网应激反应。Abstract:Objective To study the alterations of endoplasmic reticulum (ER) stress and mitochondrial damage after acute myocardial infarction (AMI).Methods A total of 40 SD rats were used in this study and 32 of them were subjected to AMI by ligation of left anterior descending artery. The rats were sacrificed and the heart tissues were collected after 1 h, 2 h, 4 h and 6 h of AMI (n=8 per group). The mRNA levels of activating transcription factor 6 alpha (
ATF6) and immunoglobulin heavy chain binding potein (BiP), as well as the expression of mitochondrial DNA (mtDNA) in cytoplasm were detected by RT-PCR. The ATP levels in the cardiomyocytes were detected by a commercial ATP assay kit. Results The mRNA levels ofATF6 and BiP were significantly increased after 1 h of AMI, which were maintained at high level from 2 h of AMI to the end of the experiment (P<0.05). The ATP concentrations in the cardiomyocytes were significantly elevated after 1 h of AMI but remarkably decreased after 4 h and 6 h of AMI (P<0.05). The release of mtDNA in cytoplasm was significantly increased after 2 h of AMI, followed by further elevations at 4 h and 6 h after AMI (P<0.05). Conclusion Mitochondrial damage is secondary to ER stress in AMI. -
急性心肌梗死具有较高的病死率,是心血管领域中的危急重症[1]。随着临床中经皮冠状动脉介入技术的迅猛发展,急性心肌梗死后及时的血运重建有效地降低了死亡率,改善了患者的预后[2]。然而,关于急性心肌梗死中心肌损伤的具体机制仍未完全阐明。最近越来越多的研究提出内质网应激在急性心肌梗死模型动物中的意义,研究显示药物可以通过抑制心肌细胞的内质网应激而发挥保护心肌的功能[3-5]。与此同时,线粒体损伤和活性氧类(reactive oxygen species, ROS)的产生也被认为是急性心肌梗死中导致心肌细胞死亡的一个主要原因[6-9]。本研究通过建立急性心肌梗死大鼠动脉模型,检测心肌细胞中激活转录因子6(activating transcription factor 6, ATF6)、免疫球蛋白重链结合蛋白(immunoglobulin heavy chain binding potein, BiP)、ATP以及线粒体DNA(mitochondrial DNA, mtDNA),首次阐述了急性心肌梗死后内质网应激与线粒体损伤变化的时间趋势,证明了内质网应激存在于急性心肌梗死后的早期时相,先于线粒体损伤,为进一步了解急性心肌梗死后心肌细胞损伤的具体机制及始动因素,为寻找相应的治疗靶点提供理论基础。
1. 材料和方法
1.1 实验分组和急性心肌梗死大鼠模型的建立
40只清洁级雄性SD大鼠(体质量200~250 g),购自成都达硕生物科技有限公司,并饲养于四川大学实验动物中心带有空气过滤装置和置于层流柜内的塑料笼内。所有大鼠均自由接触清洁的饮用水和标准大鼠饲料,饲养在37 ℃恒温环境中,保持12 h∶12 h昼夜循环。所有实验动物在进行操作前12 h开始禁食,分为两组进行操作。模型组32只:经10%水合氯醛腹腔内注射麻醉,充分麻醉后行气管插管,连接小动物呼吸机HX-300(成都泰盟科技有限公司)进行机械通气。在胸骨左侧第3或4肋间纵向切开皮肤组织,钝性分离肌肉组织暴露出肋骨。用显微尖镊打开第3或4肋间隙,使用开胸器充分暴露心脏,打开心包后寻找心脏左冠状动脉前降支主干(left anterior descending,LAD)。用7-0无创缝合针于左心耳根部下方2 mm处完全结扎LAD,结扎后可观察到心尖部组织明显变暗、变白,表明结扎LAD成功,心肌组织出现缺血区域。逐层缝合肋骨、肌肉和皮肤。对照组8只:大鼠麻醉操作同模型组,开胸后暴露LAD后逐层缝合肋骨、肌肉和皮肤。模型组大鼠完成LAD结扎后分别在1 h、2 h、4 h和6 h处死(每个时间点各8只),收集左心室心肌组织用于后续检测;对照组于处理后6 h收集心肌组织。本研究遵循我国《实验动物福利伦理审查指南(GB/T 35892 2018)》提出的原则与要求,并通过四川大学动物伦理委员会的伦理审查并备案。
1.2 实时荧光定量PCR检测心肌组织ATF6和BiP mRNA的表达
取左心室心肌组织约50 mg,置于1 mL预冷的Trizol中研磨成组织匀浆。再加入200 μL氯仿后充分混匀,室温下静置3 min后于4 ℃下以12 000×g离心15 min,小心吸取上层无色水相。加入500 μL异丙醇并充分混匀后室温下静置10 min,于4 ℃下以12 000×g离心10 min,弃上清液可见管底部白色沉淀。加入75%乙醇洗涤沉淀2次,4 ℃下以7 500×g离心5 min。最后于室温下晾干,加入DEPC水溶解。
采用TaKaRa逆转录试剂盒(D6110A, TaKaRa Bio, China),按照试剂盒说明书进行操作。分别准确加入相应试剂后,42 ℃环境中静置1 h,随后在95 ℃下处理5 min使逆转录酶失活,最终获得cDNA。采用标准的Bio-Rad荧光定量PCR试剂盒(1725270, Bio-Rad, USA)检测ATF6和BiP mRNA水平。大鼠ATF6引物上游:5′-TCAGCTGATGGCTGTCCAGT-3′;下游:5′-TGATGTGGAGGATCCTGGTG-3′。BiP引物上游:5′-CGAGGAGGAGGACAAGAAGG-3′;下游:5′-AGTTCTTGCCGTTCAAGGTG-3′。内参基因β-actin引物上游:5′-CTAAGGCCAACCGTGAAAAG-3′;下游:5′-TACATGGCTGGGGTGTTGA-3′。使用基于SYBR-Green 染色的实时荧光定量PCR 技术,采用10 μL PCR体系,首先加入5 μL SYBR-Green,再分别加入1 μL上游引物和下游引物,再加入0.5 μL cDNA,最后加入ddH2O至10 μL。实时荧光定量PCR 检测步骤:第一步,95 ℃,3 min;第二步,95 ℃,15 s;第三步,60 ℃,30 s;第四步,72 ℃,30 s ,共39个循环(第二步至第四步)。采用2-ΔΔCt法计算ATF6和BiP mRNA的相对表达量。
1.3 心肌组织ATP水平检测
采用ATP检测试剂盒(S0026,碧云天科技生物有限公司,上海)检测心肌ATP水平。取左心室心肌组织,加入裂解液后进行研磨,充分研磨后在4 ℃下以12 000×g离心5 min,取上清用于进一步检测。按照试剂盒说明书操作,向黑色不透光96孔板中每孔加入100 μL ATP检测工作液,放置5 min以消耗本底性ATP,3~5 min后加入上清液(或标准品),充分混匀后使用多功能酶标仪检测荧光强度,对照同时制备的标准曲线后计算每个样本中的ATP水平。
1.4 细胞质内线粒体DNA水平检测
采用细胞质提取试剂盒(ab65320, Abcam, USA)提取心肌细胞的细胞质。使用DNA提取试剂盒(#69504,Qiagen,USA)进一步提取细胞质中的DNA。取100 μL细胞质置于1.5 mL EP管中,按照说明书分别加入裂解液、蛋白酶K混合,在56 ℃下放置15 min。经多次DNA层析柱过滤后,将DNA溶解于100 μL DNA溶解液中。细胞质线粒体DNA水平检测同样采用基于SYBR-Green染色的实时荧光定量PCR技术。大鼠线粒体DNA引物上游:5′-CGCCTGACCAATAGCCATAA-3′;下游:5′-ATTCGACGTTAAAGCCTGAGA-3′。实时荧光定量PCR检测步骤:初始阶段,50 ℃,2 min;第一步,95 ℃,3 min;第二步,95 ℃,10 s;第三步,55 ℃,15 s;第四步,72 ℃,10 s,共39个循环(第一步至第四步)。另制备标准曲线。标准曲线为携带有大鼠线粒体DNA的质粒(SC101172,ORIGENE,USA)通过10倍梯度稀释获得。线粒体DNA浓度使用标准的转换系统转换成拷贝数。
1.5 统计学方法
所有数据采用
$\overline x $ ±s表示。多组间比较采用单因素方差分析,组间两两比较采用独立样本t检验,P<0.05为差异有统计学意义。2. 结果
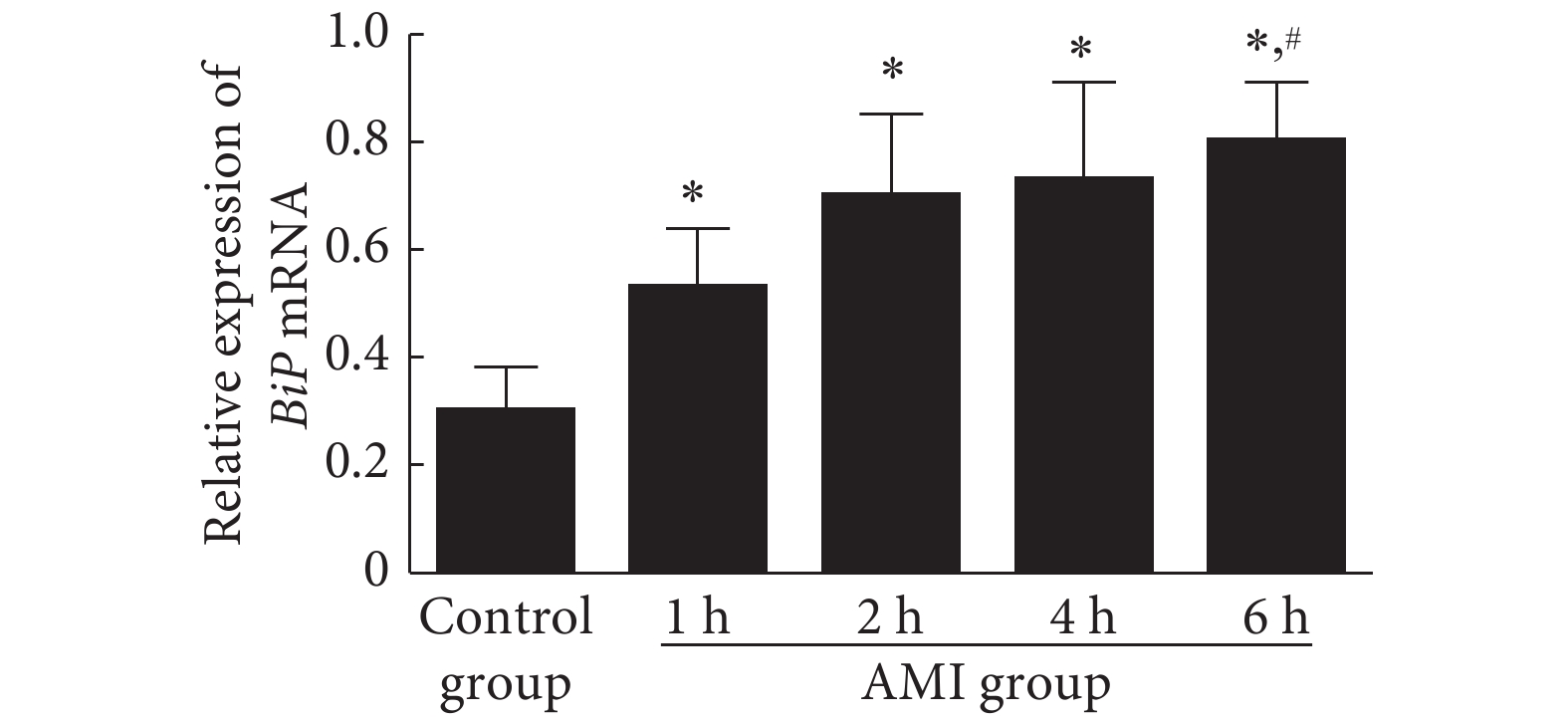
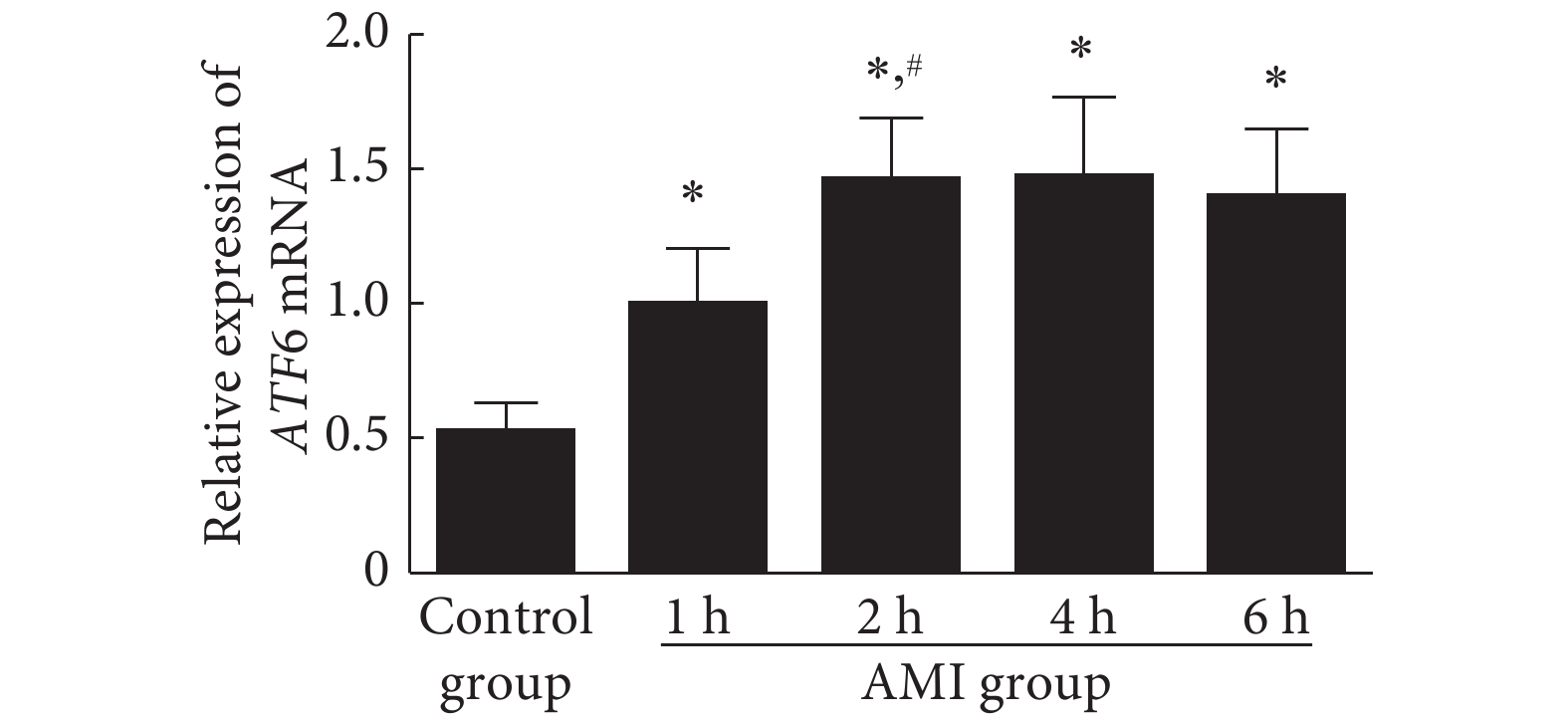
2.1 急性心肌梗死后内质网的应激变化
结果见图1、图2。与对照组比较, 在急性心肌梗死 1 h后,心肌细胞内代表内质网应激的ATF6和BiP mRNA水平均出现升高,其中ATF6在心肌梗死后2 h即达到高峰,并持续到心肌梗死后6 h未见明显下降(P<0.05),而BiP则在心肌梗死后6 h内持续升高。说明在心肌梗死后早期即存在心肌细胞的内质网应激反应。
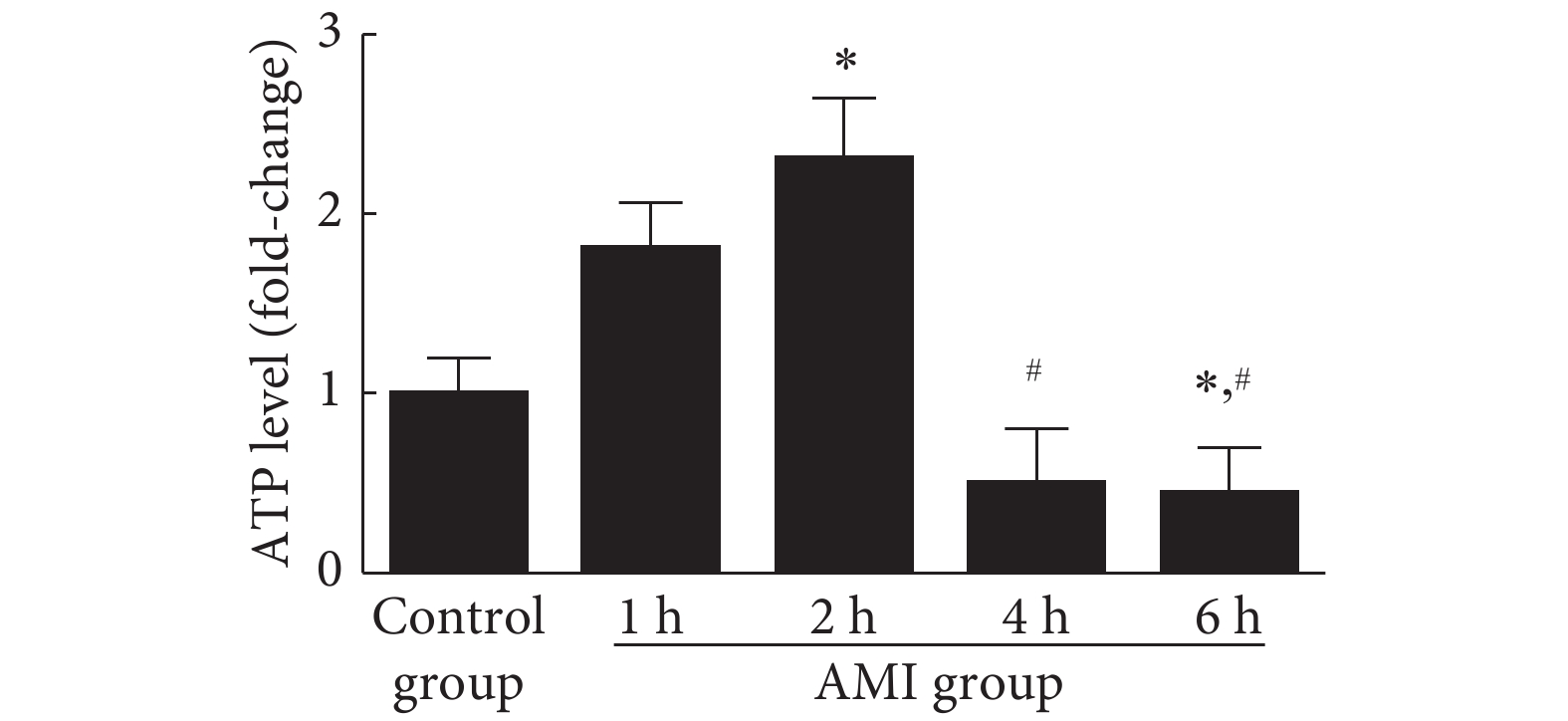
2.2 急性心肌梗死后心肌细胞内的能量代谢变化
结果见图3。相较于对照组,模型组大鼠在心肌梗死后2 h内,心肌细胞内的ATP水平增加,心肌梗死后2 h时ATP水平的差异有统计学意义(P<0.05);而在心肌梗死后4 h和6 h,ATP水平则低于对照组(P<0.05)。表明在心肌梗死后4 h才出现线粒体功能的明显损伤,晚于内质网应激反应出现的时间。
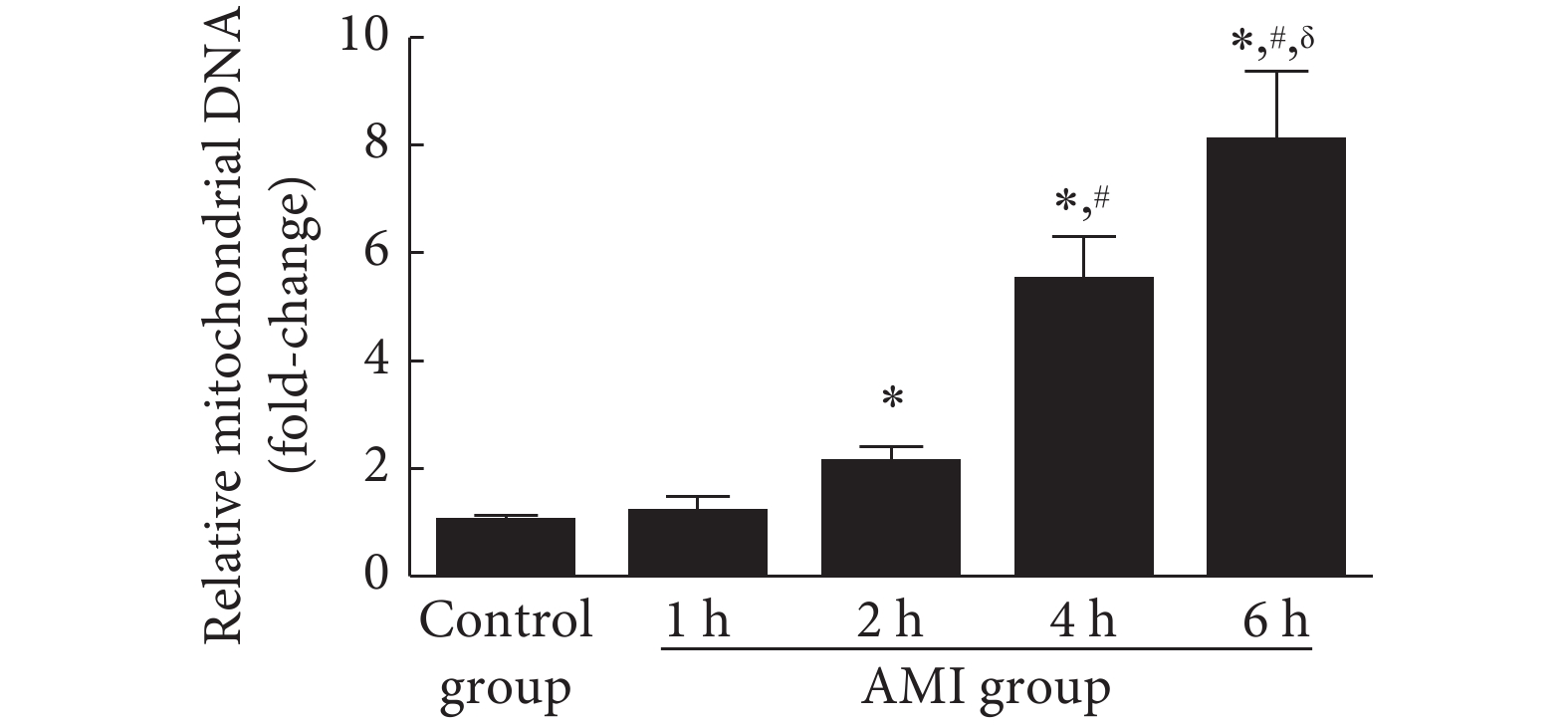
2.3 急性心肌梗死后细胞质线粒体DNA水平变化
结果见图4。模型组大鼠从心肌梗死后2 h开始出现细胞质内线粒体DNA的明显升高,并在接下来4 h内持续升高(P<0.05)。表明在心肌梗死后早期即出现了线粒体的损伤,且随着缺血时间延长线粒体损伤明显加重。
3. 讨论
本研究结果显示,在出现心肌组织的急性缺血损伤后,心肌细胞内质网应激在早期(缺血后1 h)即出现,ATF6在急性缺血2 h后即达到顶峰。而心肌细胞中的ATP水平在早期并无下降,反而在2 h内升高,4 h后开始持续在较低的水平,说明心肌细胞的能量代谢在急性心肌梗死后4 h出现了明显的抑制。作为心肌细胞中的能量单元,线粒体损伤同样出现在急性缺血2 h后,并持续升高至缺血后6 h。本研究首次提出了急性心肌梗死后内质网应激反应和线粒体损伤的变化趋势,证明了线粒体损伤发生在内质网应激反应之后。
本研究以ATF6和BiP这两个指标反映急性心肌梗死后内质网应激反应水平。ATP6在内质网应激导致的蛋白质错误折叠后被激活,诱导内质网分子伴侣蛋白的转录[10]。而BiP作为一种分子伴侣在未折叠蛋白质逐渐积累后大量产生,转运未折叠蛋白到内质网进一步折叠[11]。有报道显示,在急性心肌梗死引起的急性缺血损伤后,存在明显内质网应激反应,并通过内质网应激相关信号通路引起心肌细胞的凋亡,即可以通过迅速清除错误折叠的蛋白质和增强自噬功能来保护受损的心肌细胞[12-13]。目前已有研究提示,对急性心肌梗死后的患者使用β受体阻滞剂和西洋参、玄胡有效成分提取物,发现可以有效降低心肌组织中内质网损伤水平,从而明显改善心肌损伤[14-15]。因此越来越多的研究也提出,内质网应激反应有可能作为急性心肌梗死后的一个有效的治疗靶点[16-17]。
同时,急性心肌梗死导致的急性缺血、缺氧引起的线粒体损伤早就得到了广大医务工作者的关注。线粒体作为细胞内主要的产能器官,通过持续不断的氧化磷酸化反应为心肌收缩提供了主要的能量来源[18]。在缺血刺激下,细胞内多种信号通路激活,通过影响细胞线粒体的电子链解偶联、膜通透性转换孔的开放和细胞色素c的释放导致线粒体损伤,进而导致细胞进入死亡途径[6]。
线粒体损伤所导致的ROS大量蓄积和细胞内溶酶体的释放引起了细胞的坏死和凋亡,并可能进一步影响邻近心肌细胞而扩大心肌梗死面积[19]。有研究发现,线粒体损伤导致的循环细胞色素c在急性心肌梗死患者中虽然没有明显的诊断价值,但对于提示预后可能有帮助[20]。最近不断有研究提出线粒体DNA在发生组织和细胞损伤后会释放入血,引起无菌性炎症反应[21]。同时,有研究显示,急性心肌梗死后患者血循环中线粒体DNA水平明显升高,并且与血液中炎症因子的表达存在正相关关系[22]。本研究中我们发现在急性心肌梗死后心肌细胞细胞质中游离的线粒体DNA水平在急性缺血2 h后开始明显升高,并在6 h后仍继续升高。证实了急性心肌梗死后存在的线粒体损伤,并确定了线粒体损伤的时间变化。
本研究揭示了在心肌梗死后内质网应激反应和线粒体损伤的时间顺序,认为在心肌梗死过程中,线粒体损伤有可能继发于内质网应激反应。有研究显示,线粒体和内质网之间的相互联系控制了内质网的蛋白合成、线粒体内ATP的产生和细胞的凋亡[23]。KEMTER等[24]针对遗传性肾小管间质肾病的研究显示,内质网应激反应不仅可以影响线粒体的生物合成,还可以直接影响线粒体的功能;线粒体相关膜作为线粒体与内质网的物理接触位点,在其中发挥了重要的作用。内质网应激反应可以通过两个途径导致线粒体损伤,即未折叠蛋白反应(UPR)和钙离子信号通路。其中UPR导致的细胞凋亡途径主要通过依靠线粒体依赖的凋亡途径[23]。线粒体内一定量的钙离子浓度可以促进线粒体中的氧化磷酸化,而过高的钙离子浓度则会传递并放大细胞凋亡通路。DENIAUD等[25]发现在诱导产生内质网应激后,内质网作为钙离子的储存库,释放出大量钙离子并导致线粒体钙离子浓度迅速升高;进一步发现,线粒体呈现出凋亡形态,表现为通透性改变、电化学电势的改变、线粒体肿胀和细胞色素c的释放;但单纯诱导线粒体内钙离子的蓄积并没有引起线粒体出现凋亡形态的改变,证明了内质网应激反应在其中的诱导作用。
本研究首次证实了急性心肌梗死动物模型中内质网应激反应和线粒体损伤变化的时间趋势,发现内质网应激出现在急性缺氧、缺血早期,而线粒体损伤出现在内质网应激反应之后,因此,提出急性心肌梗死后线粒体的损伤可能继发于内质网应激反应。此外,本课题组还发现急性心肌梗死后存在谷氨酸盐代谢途径的明显改变(数据未展示)。因此我们推测,急性心肌梗死后谷氨酸盐增多导致内质网膜上N-甲基-D-天门冬氨酸受体(N-methyl-D-aspartic acid receptor, NMDA-R)表达上调,并通过线粒体内质网交联膜系统转移到线粒体膜上,导致Ca2+内流进而促进ROS系统的释放,激活Caspase-1信号通路导致心肌细胞死亡。上述推测为后续研究内容。总之,本研究为进一步理解急性心肌缺血的具体机制提供了一个新的理论基础,同时对于心肌梗死后减少心肌损伤提供了新的干预靶点。
-
-
[1] MENEES D S, PETERSON E D, WANG Y, et al. Door-to-balloon time and mortality among patients undergoing primary PCI. N Engl J Med,2013,369(10): 901–909. DOI: 10.1056/NEJMoa1208200
[2] LEVINE G N, BATES E R, BLANKENSHIP J C, et al. 2015 ACC/AHA/SCAI focused update on primary percutaneous coronary intervention for patients with ST-elevation myocardial infarction: an update of the 2011 ACCF/AHA/SCAI Guideline for Percutaneous Coronary Intervention and the 2013 ACCF/AHA Guideline for the Management of ST-Elevation Myocardial Infarction: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Society for Cardiovascular Angiography and Interventions. Circulation,2016,133(11): 1135–1147. DOI: 10.1161/CIR.0000000000000336
[3] WEI C, WANG Y, LI M, et al. Spermine inhibits endoplasmic reticulum stress-induced apoptosis: a new strategy to prevent cardiomyocyte apoptosis. Cell Physiol Biochem,2016,38(2): 531–544. DOI: 10.1159/000438648
[4] YU L, LI S, TANG X, et al. Diallyl trisulfide ameliorates myocardial ischemia-reperfusion injury by reducing oxidative stress and endoplasmic reticulum stress-mediated apoptosis in type 1 diabetic rats: role of SIRT1 activation. Apoptosis,2017,22(7): 942–954. DOI: 10.1007/s10495-017-1378-y
[5] YANG Q, WEN L, MENG Z, et al. Blockage of endoplasmic reticulum stress attenuates nilotinib-induced cardiotoxicity by inhibition of the Akt-GSK3beta-Nox4 signaling. Eur J Pharmacol,2018,822: 85–94. DOI: 10.1016/j.ejphar.2018.01.011
[6] AKHNOKH M K, YANG F H, SAMOKHVALOV V, et al. Inhibition of soluble epoxide hydrolase limits mitochondrial damage and preserves function following ischemic injury. Front Pharmacol, 2016, 7: 133[2019-10-13]. https://doi.org/10.3389/fphar.2016.00133.
[7] ERTRACHT O, MALKA A, ATAR S, et al. The mitochondria as a target for cardioprotection in acute myocardial ischemia. Pharmacol Ther,2014,142(1): 33–40. DOI: 10.1016/j.pharmthera.2013.11.003
[8] YANG J, BROWN M E, ZHANG H, et al. High-throughput screening identifies microRNAs that target Nox2 and improve function after acute myocardial infarction. Am J Physiol Heart Circ Physiol,2017,312(5): H1002–H1012. DOI: 10.1152/ajpheart.00685.2016
[9] ZOU J, FEI Q, XIAO H, et al. VEGF-A promotes angiogenesis after acute myocardial infarction through increasing ROS production and enhancing ER stress-mediated autophagy. J Cell Physiol,2019,234(10): 17690–17703. DOI: 10.1002/jcp.28395
[10] WIRES E S, HENDERSON M J, YAN X, et al. Longitudinal monitoring of Gaussia and nano luciferase activities to concurrently assess ER calcium homeostasis and ER stress in vivo. PLoS One, 2017, 12(4): e0175481[2019-10-13]. https://doi.org/10.1371/journal.pone.0175481.
[11] CASAS C. GRP78 at the centre of the stage in cancer and neuroprotection. Front Neurosci, 2017, 11: 177[2019-10-13]. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5380735/. doi: 10.3389/fnins.2017.00177.
[12] WANG S, WANG Z, FAN Q, et al. Ginkgolide K protects the heart against endoplasmic reticulum stress injury by activating the inositol-requiring enzyme 1alpha/X box-binding protein-1 pathway. Br J Pharmacol,2016,173(15): 2402–2418. DOI: 10.1111/bph.13516
[13] SHI Z Y, LIU Y, DONG L, et al. Cortistatin improves cardiac function after acute myocardial infarction in rats by suppressing myocardial apoptosis and endoplasmic reticulum stress. J Cardiovasc Pharmacol Ther,2017,22(1): 83–93. DOI: 10.1177/1074248416644988
[14] LIU M, XUE M, WANG X R, et al. Panax quinquefolium saponin attenuates cardiomyocyte apoptosis induced by thapsigargin through inhibition of endoplasmic reticulum stress. J Geriatr Cardiol,2015,12(5): 540–546.
[15] CICEK F A, TOY A, TUNCAY E, et al. Beta-blocker timolol alleviates hyperglycemia-induced cardiac damage via inhibition of endoplasmic reticulum stress. J Bioenerg Biomembr,2014,46(5): 377–387. DOI: 10.1007/s10863-014-9568-6
[16] JIN J K, BLACKWOOD E A, AZIZI K, et al. ATF6 decreases myocardial ischemia/reperfusion damage and links ER Stress and oxidative stress signaling pathways in the heart. Circ Res,2017,120(5): 862–875. DOI: 10.1161/CIRCRESAHA.116.310266
[17] WIERSMA M, MEIJERING R A M, QI X Y, et al. Endoplasmic reticulum stress is associated with autophagy and cardiomyocyte remodeling in experimental and human atrial fibrillation. J Am Heart Assoc, 2017, 6(10): pii: e006458[2019-10-13]. https://doi.org/10.1161/JAHA.117.006458.
[18] JENDRACH M, MAI S, POHL S, et al. Short- and long-term alterations of mitochondrial morphology, dynamics and mtDNA after transient oxidative stress. Mitochondrion,2008,8(4): 293–304. DOI: 10.1016/j.mito.2008.06.001
[19] WANG K, LIU C Y, ZHANG X J, et al. miR-361-regulated prohibitin inhibits mitochondrial fission and apoptosis and protects heart from ischemia injury. Cell Death Differ,2015,22(6): 1058–1068. DOI: 10.1038/cdd.2014.200
[20] MARENZI G, COSENTINO N, BOEDDINGHAUS J, et al. Diagnostic and prognostic utility of circulating cytochrome c in acute myocardial infarction. Circ Res,2016,119(12): 1339–1346. DOI: 10.1161/CIRCRESAHA.116.309792
[21] QIN C, LIU R, GU J, et al. Variation of perioperative plasma mitochondrial DNA correlate with peak inflammatory cytokines caused by cardiac surgery with cardiopulmonary bypass. J Cardiothorac Surg, 2015, 10: 85 [2019-10-13]. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4479323/. doi: 10.1186/s13019-015-0298-6.
[22] QIN C, GU J, LIU R, et al. Release of mitochondrial DNA correlates with peak inflammatory cytokines in patients with acute myocardial infarction. Anatol J Cardiol,2017,17(3): 224–228.
[23] KIM S H, KIM K Y, YU S N, et al. Silibinin induces mitochondrial NOX4-mediated endoplasmic reticulum stress response and its subsequent apoptosis. BMC Cancer, 2016, 16: 452[2010-10-13]. https://bmccancer.biomedcentral.com/articles/10.1186/s12885-016-2516-6. doi: 10.1186/s12885-016-2516-6.
[24] KEMTER E, FROHLICH T, ARNOLD G J, et al. Mitochondrial dysregulation secondary to endoplasmic reticulum stress in autosomal dominant tubulointerstitial kidney disease-UMOD (ADTKD-UMOD). Sci Rep, 2017, 7: 42970[2010-10-13]. https://www.nature.com/articles/srep42970. doi: 10.1038/srep42970.
[25] DENIAUD A, SHARAF EL DEIN O, MAILLIER E, et al. Endoplasmic reticulum stress induces calcium-dependent permeability transition, mitochondrial outer membrane permeabilization and apoptosis. Oncogene,2008,27(3): 285–299. DOI: 10.1038/sj.onc.1210638
-
期刊类型引用(5)
1. 梁伟霄,郭凤娟,陈要起,杨晔娟,刘雨. 非糖尿病急性心肌梗死患者应激性高血糖的危险因素分析及LDL-C/HDL-C比值的预测效能. 分子诊断与治疗杂志. 2025(01): 50-53 .  百度学术
百度学术
2. 徐林松,杨宝刚,张心怡,王占英,李沙,康伟格. miR-199b-5p在心肌梗死大鼠心肌纤维化及内质网应激中的作用及机制. 检验医学与临床. 2025(07): 914-919 .  百度学术
百度学术
3. 周元,张加荣,徐敏. 医疗失效与效应分析模式对PCI患者术后并发症、不良事件发生率及护理满意度的影响. 国际护理学杂志. 2024(10): 1761-1764 .  百度学术
百度学术
4. 卢迎宏,王丹,井海云,王梦超,李智慧. 胰激肽原酶缓解心肌缺血再灌注损伤大鼠氧化应激和纤维化. 中国比较医学杂志. 2022(03): 23-30 .  百度学术
百度学术
5. 王鹏飞,李硕,王瑞鹃,侯瑞田,丁振江,刘超. 外周血线粒体DNA与慢性心力衰竭病情及近期预后的关系. 中国医刊. 2021(04): 382-385 .  百度学术
百度学术
其他类型引用(4)

 首页
首页



 下载:
下载: