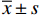-
摘要:目的 观察关节炎大鼠心功能的变化及雷公藤甲素的干预作用,探讨其可能的作用机制。方法 将40只大鼠随机分为正常对照(NC)组、模型对照(MC)组、来氟米特(LEF)组和雷公藤甲素(TP)组。除NC组外,其余各组大鼠右后足跖皮内注射弗氏完全佐剂制备关节炎模型,制模第12天开始给药干预,TP组、LEF组大鼠分别灌胃其混悬液(TP 0.1 mg/mL,LEF 0.5 mg/mL)1 mL/100 g (体质量),NC组、MC组大鼠相应时间灌胃等量的生理盐水,给药30 d。末次用药24 h后,采用左心室插管术检测大鼠心功能;应用酶联免疫吸附实验法测定血清超氧化物歧化酶(SOD)、丙二醛(MDA)、活性氧(ROS)、总抗氧化能力(T-AOC)、白细胞介素-10(IL-10)、肿瘤坏死因子-α(TNF-α)水平。采用荧光定量PCR法检测心组织Keap样蛋白1(Keap1)、肌腱膜纤维肉瘤(maf)、核因子-E2相关因子2(Nrf2)mRNA表达;采用Western blot法检测心组织Keap1、maf、Nrf2蛋白表达。结果 ① 与NC组比较,MC组大鼠的心功能指标中心率(HR)、心脏指数(HI)、左心室收缩压(LVSP)、左心室舒张末压(LVEDP)升高,左心室压力上升和下降最大变化率(±dp/dtmax)降低(P均<0.01)。SOD、MDA、ROS、T-AOC、TNF-α升高,IL-10降低 (P均<0.01)。心组织Keap1、maf、Nrf2 mRNA和蛋白表达均升高(P<0.01)。② 与MC组比较,TP组大鼠HR、LVSP、HI、LVEDP降低,±dp/dtmax升高(P<0.01)。TNF-α、T-AOC、MDA、SOD、ROS下降,IL-10升高(
P <0.05或 P <0.01)。TP组大鼠心组织Keap1、maf、Nrf2 mRNA和蛋白表达降低(P<0.01)。 结论 TP可改善关节炎大鼠心功能,其机制可能与提高心肌细胞抗氧化能力、减轻氧化应激损伤、抑制异常免疫炎症反应有关。Abstract:Objective To observe the changes of cardiac function in arthritic rats and the effect of triptolide on it.Methods Forty rats were divided in random into normal control (NC) group, model control (MC) group, leflunomide (LEF) group and triptolide (TP) group. Except for the normal group, rats in the other three groups were injected with Freund's complete adjuvant to create arthritic inflammation in the right hind paws, and the interventional drug was administered on the 12th day after the inflammation. By treating for 30 d, the cardiac function of rats was detected by left ventricular catheterization. The expressions of superoxide dismutase (SOD), malondialdehyde (MDA), reacitve oxygen species (ROS), total antioxidation (T-AOC), interleukin-10 (IL-10) and tumor necrosis factor-α (TNF-α) in serum were measured by enzyme-linked immunosorbent assay. The expressions of keap-like protein 1 (Keap1), muscular aponeurotic fibrosarcom (maf) and nuclear factor-E2 related factor2 (Nrf2) mRNAs in cardiac tissue were detected by real-time PCR. The expressions of Keap1, maf and Nrf2 proteins in heart tissues were detected by Western blot.Results Comparing with the normal group, the heart rate (HR), heart index (HI), left ventricular systolic pressure (LVSP), and left ventricular end-diastolic pressure (LVEDP) of the model group were significantly increased, whereas the maximum change rate of ventricular pressure rise or decline (±dp/dtmax) was significantly decreased (P<0.01). SOD, MDA, ROS, T-AOC, and TNF-α were all increased, and IL-10 was significantly decreased (P<0.01). The mRNA and protein expressions of Keap1, maf and Nrf2 in heart tissues were increased (P<0.01). Comparing with the model group, HR, HI, LVSP, and LVEDP in the triptolide group were significantly decreased, whereas the ±dp/dtmax was significantly increased (P<0.01). SOD, MDA, T-AOC, ROS, TNF-α decreased while the IL-10 increased (P<0.05, P<0.01). The expressions ofKeap1, maf and Nrf2 mRNAs and proteins in the heart tissues of the triptolide group were decreased (P<0.01). Conclusion Triptolide could improve cardiac function in arthritic rats, and the mechanism may related to its ability of improving the anti-oxidationin cardiomyocytes, reducing oxidative stress damage, and inhibiting abnormal immune inflammatory response.-
Keywords:
- Adjuvant arthritis /
- Cardiac function /
- Oxidative stress /
- Triptolide
-
类风湿关节炎(rheumatoid arthritis,RA) 是以关节滑膜炎为特征的慢性全身性自身免疫疾病,因免疫过度活跃,常伴随其他脏器病变和损伤[1]。心脏富含结缔组织和血管,RA患者心脏受损或受累几率更大。研究[2-3]显示,RA的免疫失调状态、炎症的不断刺激可能是发生心脏结构和功能异常的原因之一。氧化应激在RA发病中起重要作用,氧化应激分子参与调节RA相关基因表达,进而对其相关组织脏器(如关节、心脏等)产生损伤[4-5]。核因子-E2相关因子2(nuclear factor-E2 related factor2, Nrf2)是一种核转录因子,可调节许多重要的抗氧化和抗炎基因表达。Nrf2抗氧化作用过程与多种细胞因子相互联系[6]。Nrf2信号通路受Keap样蛋白1(keap-like protein 1, Keap1)调控。Nrf2与Keap1相互作用,并在蛋白-蛋白酶体途径快速降解[7],从而发生氧化应激反应。
中药单体雷公藤甲素(triptolide,TP)是雷公藤主要成分之一。研究[8-9]显示,TP可阻止炎性分子增多引起的RA炎症反应,改善关节炎症及调节氧化应激状态。雷公藤萜类通过免疫抑制对心肌缺血具有保护作用[10]。为进一步研究关节炎动物模型大鼠在发生自身免疫性病变时心脏结构和功能的变化,以及TP对其变化的影响,本研究通过制备经典的佐剂关节炎大鼠模型,观察TP干预对大鼠心功能、心脏结构、血清氧化应激等指标变化的影响,并通过检测心脏组织中相关基因的表达变化,探讨TP的作用机制。
1. 材料与方法
1.1 实验动物
清洁级SD雄性大鼠40只,体质量(120±15) g,由安徽省实验动物中心提供。动物许可证号:scxk(皖)2017-006。
1.2 主要药品和试剂
TP由上海源叶生物科技公司提供,纯度>90%。来氟米特(leflunomide, LEF)片(10 mg/片,为临床常规治疗RA等自身免疫性疾病药物):福建汇天药业公司生产。弗氏完全佐剂:Sigma公司;白细胞介素-10(interleukin-10,IL-10)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、活性氧(reacitve oxygen species,ROS)、总抗氧化能力(total antioxidation,T-AOC)酶联免疫吸附法(enzyme-linked immunosorbent assay, ELISA)检测试剂盒:美国RD公司。兔抗Keap1和鼠抗肌腱膜纤维肉瘤(muscular aponeurotic fibrosarcom,maf)、Nrf2抗体、goat anti-rabbit IgG、goat anti-mouse IgG:美国Bioworld公司。实时荧光定量PCR反应试剂盒:美国Thermo公司。Trizol 试剂盒:美国Invitrogen公司。反转录试剂盒:日本TaKaRa公司。
1.3 实验方法
1.3.1 关节炎模型制备及给药
将40只大鼠随机均分为正常对照(normal control, NC)组、模型对照(model control, MC)组、LEF组、TP组。除NC组大鼠外,其余组大鼠向右后足跖皮内注射弗氏完全佐剂0.1 mL致炎,制备关节炎模型[11]。制模第12天后进行干预给药。TP组、LEF组大鼠:分别将TP、LEF加生理盐水,配制成TP 0.1 mg/mL,LEF 0.5 mg/mL混悬液,混悬液按1 mL/100 g (体质量)的剂量灌胃,每天1次,连续给药30 d。NC组、MC组大鼠:相应时间灌胃等量的生理盐水(1 mL/100 g)灌胃,每天1 次,连续30 d。末次用药24 h后,检测大鼠心功能,取血清检测氧化应激等指标,处死大鼠,取心脏组织进行组织病理形态学观察,检测心脏组织相关基因的表达。佐剂关节炎大鼠模型是RA经典模型,本课题组前期研究[11]采用相同方法也成功制备RA模型,本研究对局部关节的炎性指标不再进行验证。
1.3.2 大鼠心功能检测
用10%的水合氯醛300 mg/kg (1 mL/100 g)腹腔注射麻醉大鼠。采用左心室插管术检测大鼠心功能[11]。心功能指标包括心率(heart rate, HR)、左心室收缩压(left ventricular systolic pressure, LVSP)、左心室舒张末压(left ventricular end diastolic pressure, LVEDP)、左心室压力上升和下降最大变化率(maximum change rate of left ventricular pressure rise and fall, ±dp/dtmax)、心脏指数(heart index, HI)等心功能参数。
1.3.3 ELISA法检测大鼠血清细胞因子及氧化应激指标
检测指标包括IL-10、TNF-α、SOD、MDA、ROS、T-AOC,具体操作步骤按ELISA试剂盒说明书进行。
1.3.4 大鼠心脏组织病理形态学观察
打开大鼠胸腔取心脏组织,去除周围结缔组织,将心组织依次予脱水、透明、浸蜡和包埋,切片,常规HE染色。光镜下观察病理形态学变化。
1.3.5 实时荧光定量PCR检测大鼠心脏组织Keap1、maf、Nrf2 mRNA的表达
根据美国国家生物技术信息中心(national center for biotechnology information,NCBI) GenBank库提供的Keap1、maf、Nrf2及内参照β-actin序列设计引物。序列见表1。引物由上海生工公司完成合成。用Trizol 试剂盒提取大鼠心组织总RNA。按照反转录试剂盒说明进行反转录。PCR反应体系为20 μL,包括2×Goldstar Taqman mixture预混体系10 μL,反转录产物2 μL,正、反向引物各0.4 μL探针0.4 μL,水补足至20 μL。条件:95 ℃ 预变性10 min,40个循环:变性(95 ℃)15 s,退火40 s,延伸(60 ℃)60 s。以β-actin作为内参,计算ΔCt,以2−ΔΔCt计算目的mRNA的相对表达量。
表 1 基因引物序列与预扩增长度Table 1. Gene primer sequences and preamplification lengthGene Primer sequence Product length Nrf-2 F: 5′- TAG ATG ACC ATG AGT CGC TTG-3′
R: 5′- GCC AAA CTT GCT CCA TGT CC-3′197 bp maf F: 5′-TTG GTT TAT CTG GCT CAT-3′
R: 5′- AGT CCG TCA GTG TTA TTC A-3′147 bp Keap1 F: 5′- CCG CAG AAT GTT ACT ATC CAG AG-3′
R: 5′- CGC TCC ACA CTG TTC AAC TG-3′197 bp β-actin F: 5′-TTG TAA CCA CCT GGG ACG ATA TGG-3′
R: 5′-GAT CTT GAT CTT CAT GGT GCT AG-3′212 bp 1.3.6 免疫印迹法检测心脏组织Keap1、maf、Nrf2 蛋白的表达
提取心脏组织总蛋白,用紫外吸收法测定总蛋白含量,将蛋白质量浓度调至2 μg/μL;取5 μL总蛋白,加上样缓冲液10 μL煮沸5 min,取出上样。电泳分离;转膜;封闭;孵育一抗:将Keap1、maf、Nrf2抗体1∶1 000稀释;将稀释好的一抗和膜室温下孵育1−2 h;洗涤:用磷酸缓冲盐溶液洗涤(5 min, ×3);孵育二抗:Keap1采用抗兔二抗,maf、Nrf2采用抗鼠二抗,稀释比例均为1∶5 000。室温孵育30−60 min;用磷酸缓冲盐溶液洗涤(5 min, ×5)。显色:采用增强化学发光法显色。数据分析处理:用扫描仪对胶片进行扫描摄像;采用Band Scan软件对条带进行分析处理,以条带与各组内参β-actin灰度值的比值做为Keap1、maf、Nrf2蛋白相对表达量。
1.4 统计学方法
连续型变量以
$\overline x \pm s$ 表示。组间比较采用t检验,α=0.05。2. 结果
2.1 各组大鼠心功能参数比较
见图1。与NC组大鼠比较,MC组大鼠心功能参数HR、LVSP、HI、LVEDP升高,±dp/dtmax降低,差异有统计学意义(P<0.01)。与MC组比较,TP组大鼠HR、LVSP、HI、LVEDP降低,±dp/dtmax升高,差异有统计学意义(P<0.01)。与LEF组比较,TP组大鼠HR降低、LVEDP升高(P<0.05)。
![]() 图 1 TP对关节炎大鼠心功能指标的影响(n=10)HR: Heart rate; LVSP: Left ventricular systolic pressure; ±dp/dtmax: Maximum change rate of ventricular pressure rise or decline; HI: Heart index; LVEDP: Left ventricular end-diastolic pressure; 1 mmHg=0.133 kPa.**P<0.01, vs. NC group; △P<0.05,△△ P<0.01, vs. MC group; #P<0.05, vs. LEF groupFigure 1. Effect of triptolide on cardiac function in arthritic rats (n=10)
图 1 TP对关节炎大鼠心功能指标的影响(n=10)HR: Heart rate; LVSP: Left ventricular systolic pressure; ±dp/dtmax: Maximum change rate of ventricular pressure rise or decline; HI: Heart index; LVEDP: Left ventricular end-diastolic pressure; 1 mmHg=0.133 kPa.**P<0.01, vs. NC group; △P<0.05,△△ P<0.01, vs. MC group; #P<0.05, vs. LEF groupFigure 1. Effect of triptolide on cardiac function in arthritic rats (n=10)2.2 各组大鼠血清细胞因子及氧化应激指标变化
见表2。与NC组比较,MC组,大鼠血清细胞因子TNF-α及氧化指标T-AOC、MDA、SOD、ROS均升高,IL-10降低,差异均有统计学意义 ( P<0.01),TP组和LEF组与NC组大鼠各指标的差异无统计学意义。与MC组比较,TP、LEF组大鼠TNF-α、T-AOC、MDA、ROS均下降,IL-10升高,差异均有统计学意义(P<0.05或 P<0.01)。与LEF组相比,TP组IL-10升高,SOD、ROS降低(P<0.05)。
表 2 各组大鼠氧化应激指标及细胞因子的表达($\overline x \pm s$ ,n=10)Table 2. Indexes of oxidative stress and cytokine expressions in each group ($\overline x \pm s$ ,n=10)Group TNF-α/(IU/mL) IL-10/(IU/mL) T-AOC/(U/mL) MDA/(mol/L) SOD/(U/L) ROS/(IU/mL) NC 50.17±10.36 112.73±23.75 1.57±0.18 0.65±0.14 79.34±12.56 96.75±24.36 MC 95.43±16.76** 59.72±19.64** 3.87±0.26** 2.96±0.49** 92.46±20.47** 176.31±5.76** TP 61.47±25.74△△ 97.63±30.78△△,# 2.89±0.76△ 1.73±0.47△ 82.34±15.82△,# 122.40±26.82△△,# LEF 59.73±11.25△△ 86.36±17.68△△ 2.72±0.82△ 1.38±0.56△ 90.34±25.76 142.74±30.34△△ **P<0.01, vs. NC group; △ P<0.05, △△ P<0.01, vs. MC group; # P<0.05, vs. LEF group 2.3 大鼠心脏组织病理形态学变化
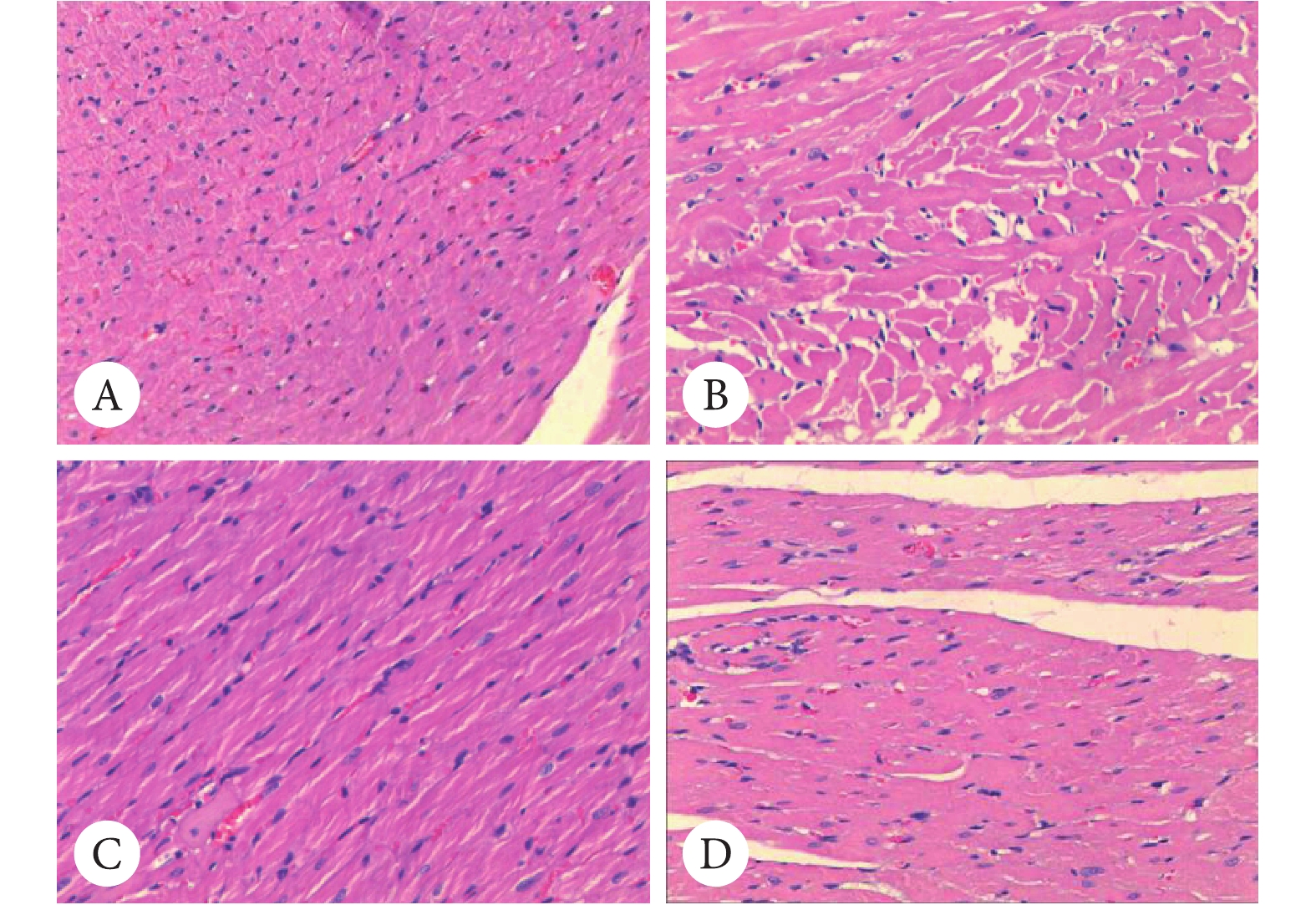
大鼠心肌病理形态学观察(图2)发现,NC组大鼠心肌纤维排列整齐,细胞核形态规整。MC组大鼠心肌纤维水肿、相互分隔增宽;细胞内肌原纤维数量增多,切面可见部分心肌纤维排列紊乱、拥挤,呈“分枝”状和“漩涡”状。细胞核深染,形状不整,其横截面心肌细胞横径值(TDM/μm)高于NC组。部分心肌组织被纤维组织代替,出现不成比例的结缔组织增生和脂肪变性、肌肉细胞的细胞核固缩。TP组心肌纤维排列较规整,部分结缔组织增生和脂肪变性,偶见心肌纤维水肿。LEF组心肌组织被纤维组织代替,出现不成比例的结缔组织增生和脂肪变性、肌肉细胞的细胞核固缩。
2.4 大鼠心脏组织Keap1、maf、Nrf2 mRNA的表达
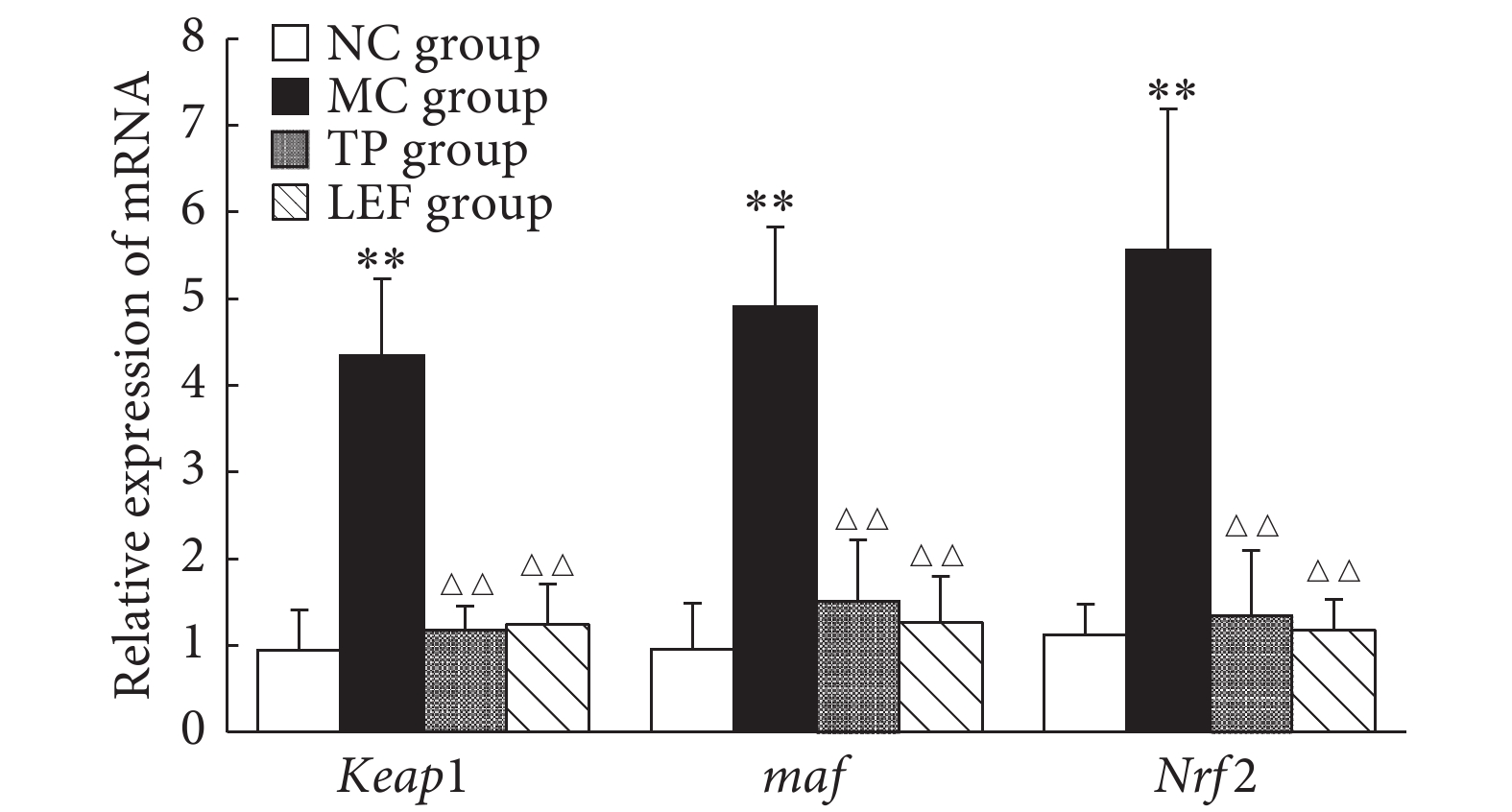
见图3。与NC组比较,MC组大鼠心组织Keap1、maf 、Nrf2 mRNA表达升高(P<0.01),TP组和LEF组与NC组大鼠各mRNA的表达差异无统计学意义;与MC组比较,TP和LEF组大鼠心组织Keap1、maf、Nrf2 mRNA表达降低(P<0.01),TP和LEF组间差异无统计学意义。
2.5 心脏组织Keap1、maf、Nrf2 蛋白的表达
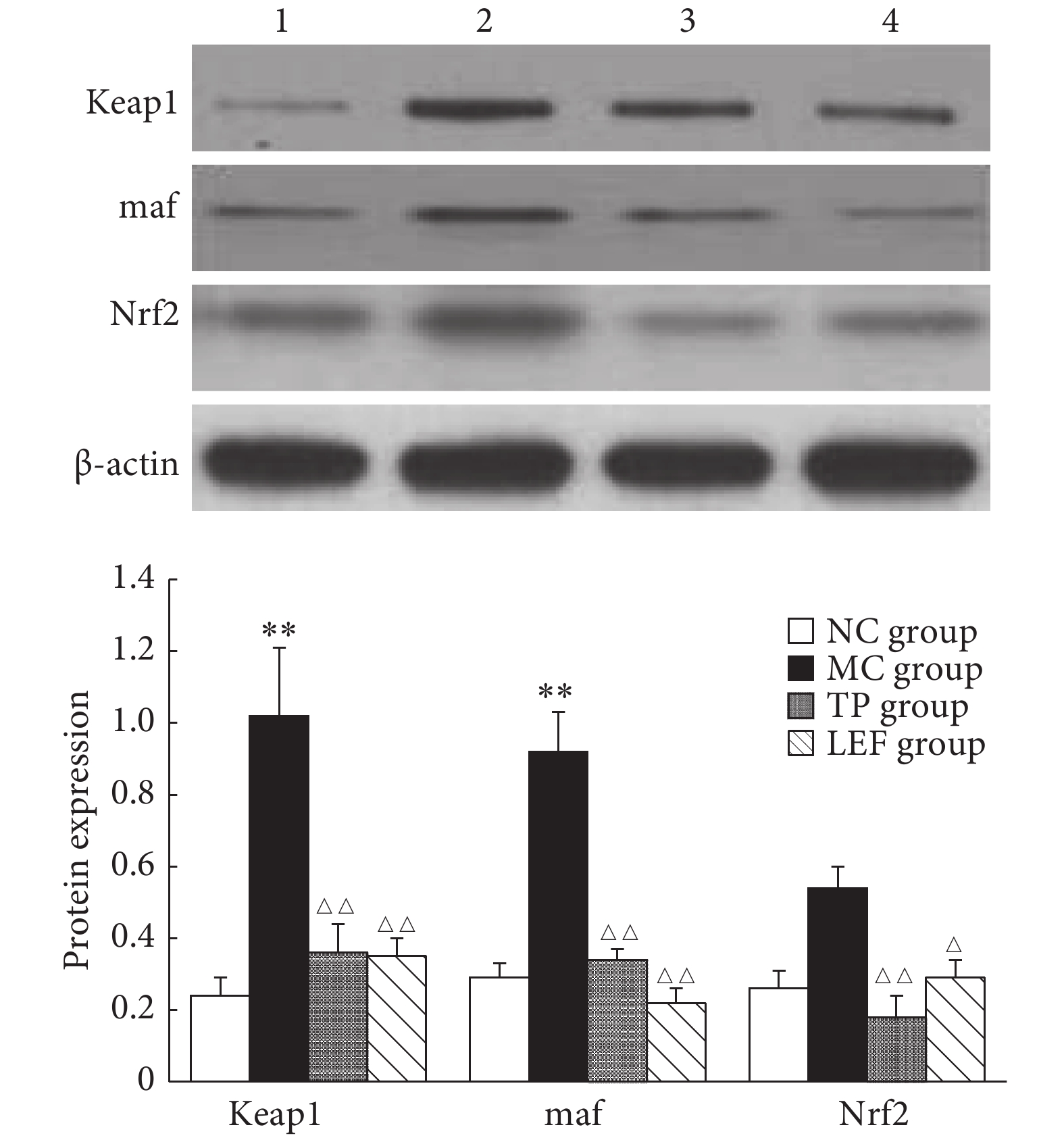
见图4。与NC组比较,MC组大鼠心脏组织Keap1、maf蛋白均表达升高(P<0.01),TP组和LEF组与NC组各蛋白的表达差异无统计学意义。与MC组比较,TP、LEF组大鼠心脏组织Keap1、maf、Nrf2蛋白降低(P<0.05或P<0.01)。
3. 讨论
全身性炎症可能导致内皮功能障碍,从而导致动脉粥样硬化和心血管疾病[12-13]。RA通过引起血管炎增加心血管疾病的风险。RA患者心血管疾病死亡风险增加,研究显示[14],RA患者心血管疾病发生率比普通人群高30%~60%,有此并发症死亡的占RA总死亡人数的一半。RA慢性炎症还会引发急性期心肌淀粉样蛋白沉积,这可能导致发生一系列病理改变,包括传导缺陷、心脏肥大、心肌病和心力衰竭等[15]。RA心力衰竭可能以左室舒张功能失衡为主要表现[16]。本研究针对RA心脏病变特点,进一步观察心功能降低的可能影响因素,这是在既往研究基础上的创新。本研究结果显示,关节炎模型大鼠心肌细胞有明显病理改变,包括心肌纤维水肿、增大,心肌纤维排列紊乱、心肌组织被纤维组织代替等。这些变化符合临床慢性心功能不全的表现。同时,关节炎模型大鼠有心功能下降,主要表现在HR、HI、LVSP、LVEDP升高和±dp/dtmax降低。说明关节炎模型在发生关节炎症时,其心功能也发生改变。与本课题组前期研究结果[11]符合。
RA心脏病变的潜在免疫机制主要归因于炎症反应。氧化应激反应异常可能促使炎性细胞因子TNF-α、IL-1和IL-6增加。在关节炎症和RA心脏病变之间也可能存在一定程度的共同炎症介质。细胞因子TNF-α、IL-10在RA发生、发展中起重要作用。RA疾病发生时致使炎性介质渗出,大量中性粒细胞聚集释放出溶酶体酶,而导致滑膜炎症和关节破坏。TNF-α能刺激滑膜细胞炎症介导成纤维细胞增生。而IL-10能抑制RA病理免疫进程。本研究结果显示,关节炎模型大鼠血清TNF-α升高,而IL-10下降,且关节炎出现心功能损伤时,其细胞因子TNF-α、IL-10均出现表达异常。而氧化应激异常也参与关节炎TNF-α、IL-10表达过程。Keap1-Nrf2为机体抗氧化调节通路,Keap1是Nrf2的负调节因子[17]。当受外界氧化刺激时,导致Nrf2和Keap1解耦联,Nrf2和Keap1表达增加,氧化应激表达活跃,从而诱导抗氧化酶基因转录[18]。本研究显示,关节炎模型大鼠心脏组织存在Keap1- Nrf2通路的异常激活,表现为心脏组织Keap1、maf、Nrf2表达升高,且血清氧化指标SOD、MDA、ROS、T-AOC均升高。说明关节炎大鼠在发生免疫炎症反应的同时,也激活了其氧化应激通路,参与炎症反应及心肌细胞破坏。Keap1增殖致使Keap1解离,活化的Nrf2表达减少,Nrf2在核内与maf蛋白结合减少而抑制基因转录。由此我们推测,关节炎发生、发展时,可能由于Keap1- Nrf2通路的过度激活,SOD、MDA、T-AOC、ROS等氧化产物的产生过多,超出氧化物的清除,从而导致了机体促炎因子TNF-α上调,抑炎因子IL-10下调,免疫炎症反应增加,致使机体长期处于慢性炎症状态,导致免疫复合物的大量形成,在心脏等含有丰富的结缔组织和血管的组织发生沉积,从而引起关节和心、血管内皮的组织损伤,导致心功能下降。
RA心脏病变治疗目前并无相关指南及建议。欧洲风湿病学会建议:为降低RA心血管病风险,需尽可能控制RA关节炎症活动。抗风湿治疗对RA心功能损伤有一定影响。一项小样本的对照试验随访了5年,发现包括LEF在内的治疗对RA等容舒张时间等舒张功能指标有所改善[19]。本研究发现,经TP和LEF药物干预治疗,均可改善关节炎大鼠心功能水平,特别是经TP治疗后大鼠心功能参数降低,±dp/dtmax显著升高。说明TP可显著改善关节炎大鼠心功能水平。并且发现TP和LEF组大鼠心组织Keap1、maf、Nrf2 基因和蛋白表达降低。说明TP和LEF药物干预可以通过调控Keap1-Nrf2通路的表达,达到调节机体氧化应激反应的作用,进而改善炎症反应及心肌损伤。研究发现[20],过度的氧化应激和炎症反应在RA的发病机制中起着重要作用。雷公藤具有抗氧化作用[21-22]。雷公藤多年来被广泛用于治疗自身免疫性和炎症性疾病,雷公藤分离的TP显示出广泛抗炎症、免疫抑制和抗氧化剂作用[23-25]。TP制品能抑制减少一氧化氮释放,抑制环氧化酶和诱导型一氧化氮合酶(iNOS)基因表达,抑制氧化应激[26]。双荧光素酶报告基因也证明TP可通过调节Nrf2信号通路发挥抗氧化作用[27]。雷公藤能保护细胞线粒体结构,提高细胞内SOD活性,减轻心肌细胞膜损伤而改善心肌缺血。
综上所述,关节炎大鼠存在心功能下降,其原因可能是免疫炎症反应使得体内氧化应激功能紊乱所致。TP能够改善心功能,其机制可能是通过调控Keap1-Nrf2通路基因和蛋白的表达,调节机体氧化应激反应,提高心肌细胞抗氧化能力,减轻氧化应激损伤、抑制异常免疫炎症反应有关。
-
图 1 TP对关节炎大鼠心功能指标的影响(n=10)
HR: Heart rate; LVSP: Left ventricular systolic pressure; ±dp/dtmax: Maximum change rate of ventricular pressure rise or decline; HI: Heart index; LVEDP: Left ventricular end-diastolic pressure; 1 mmHg=0.133 kPa.**P<0.01, vs. NC group; △P<0.05,△△ P<0.01, vs. MC group; #P<0.05, vs. LEF group
Figure 1. Effect of triptolide on cardiac function in arthritic rats (n=10)
表 1 基因引物序列与预扩增长度
Table 1 Gene primer sequences and preamplification length
Gene Primer sequence Product length Nrf-2 F: 5′- TAG ATG ACC ATG AGT CGC TTG-3′
R: 5′- GCC AAA CTT GCT CCA TGT CC-3′197 bp maf F: 5′-TTG GTT TAT CTG GCT CAT-3′
R: 5′- AGT CCG TCA GTG TTA TTC A-3′147 bp Keap1 F: 5′- CCG CAG AAT GTT ACT ATC CAG AG-3′
R: 5′- CGC TCC ACA CTG TTC AAC TG-3′197 bp β-actin F: 5′-TTG TAA CCA CCT GGG ACG ATA TGG-3′
R: 5′-GAT CTT GAT CTT CAT GGT GCT AG-3′212 bp 表 2 各组大鼠氧化应激指标及细胞因子的表达(
$\overline x \pm s$ ,n=10)Table 2 Indexes of oxidative stress and cytokine expressions in each group (
$\overline x \pm s$ ,n=10)Group TNF-α/(IU/mL) IL-10/(IU/mL) T-AOC/(U/mL) MDA/(mol/L) SOD/(U/L) ROS/(IU/mL) NC 50.17±10.36 112.73±23.75 1.57±0.18 0.65±0.14 79.34±12.56 96.75±24.36 MC 95.43±16.76** 59.72±19.64** 3.87±0.26** 2.96±0.49** 92.46±20.47** 176.31±5.76** TP 61.47±25.74△△ 97.63±30.78△△,# 2.89±0.76△ 1.73±0.47△ 82.34±15.82△,# 122.40±26.82△△,# LEF 59.73±11.25△△ 86.36±17.68△△ 2.72±0.82△ 1.38±0.56△ 90.34±25.76 142.74±30.34△△ **P<0.01, vs. NC group; △ P<0.05, △△ P<0.01, vs. MC group; # P<0.05, vs. LEF group -
[1] PEÇANHA T, RODRIGUES R, PINTO A J, et al. Chronotropic incompetence and reduced heart rate recovery in rheumatoid arthritis. J Clin Rheumatol,2018,24(7): 375–380. DOI: 10.1097/RHU.0000000000000745
[2] ZIMMERMANN M, VODICKA E, HOLMAN A J, et al. Heart rate variability testing: could it change spending for rheumatoid arthritis patients in the United States? An exploratory economic analysis J Med Econ,2018,21(7): 712–720. DOI: 10.1080/13696998.2018.1470519
[3] DUDEK M, KAŁUŻNA-OLEKSY M, MIGAJ J, et al. Difficult diagnosis of heart failure in rheumatoid arthritis: six-year follow-up of constrictive pericarditis.Kardiol Pol, 2018, 76(3): 675[2019-05-06]. https://doi.org/10.5603/KP.2018.0066.
[4] PHULL A R, NASIR B, HAQ I U, et al. Oxidative stress, consequences and ROS mediated cellular signaling in rheumatoid arthritis. Chem Biol Interact,2018,281: 121–136. DOI: 10.1016/j.cbi.2017.12.024
[5] BALA A, MONDAL C, HALDAR P K, et al. Oxidative stress in inflammatory cells of patient with rheumatoid arthritis: clinical efficacy of dietary antioxidants. Inflammopharmacology,2017,25(6): 595–607. DOI: 10.1007/s10787-017-0397-1
[6] CHU J, WANG X, BI H, et al. Dihydromyricetin relieves rheumatoid arthritis symptoms and suppresses expression of pro-inflammatory cytokines via the activation of Nrf2 pathway in rheumatoid arthritis model. Int Immunopharmacol,2018,59: 174–180. DOI: 10.1016/j.intimp.2018.04.001
[7] LOBODA A, DAMULEWICZ M, PYZA E, et al. Role of Nrf2/HO-1 system in development, oxidative stress response and diseases: an evolutionarily conserved mechanism. Cell Mol Life Sci,2016,73(17): 3221–3247. DOI: 10.1007/s00018-016-2223-0
[8] WANG S, ZUO S, LIU Z, et al. Study on the efficacy and mechanism of triptolide on treating TNF transgenic mice with rheumatoid arthritis. Biomed Pharmacother,2018,106: 813–820. DOI: 10.1016/j.biopha.2018.07.021
[9] FAN D, HE X, BIAN Y, et al. Triptolide modulates TREM-1 signal pathway to inhibit the inflammatory response in rheumatoid arthritis. Int J Mol Sci, 2016, 17(4): 498[2019-05-06]. https://doi.org/10.3390/ijms17040498.
[10] LIANG Z, LEO S, WEN H, et al.Triptolide improves systolic function and myocardial energy metabolism of diabetic cardiomyopathy in streptozotocin-induced diabetic rats. BMC Cardiovasc Disord, 2015, 15: 42[2019-05-06]. https://doi.org/10.1186/s12872-015-0030-4.
[11] 刘健, 曹云祥, 朱艳. 新风胶囊对佐剂性关节炎大鼠心功能及心肌超微结构影响. 中国中西医结合杂志,2012,32(11): 1543–1548. [12] OGDIE A, YU Y, HAYNES K, et al. Risk of major cardiovascular events in patients with psoriatic arthritis, psoriasis and rheumatoid arthritis: a population-based cohort study. Ann Rheum Dis,2015,74(2): 326–332. DOI: 10.1136/annrheumdis-2014-205675
[13] SINNATHURAI P, CAPON A, BUCHBINDER R, et al. Cardiovascular risk management in rheumatoid and psoriatic arthritis: online survey results from a national cohort study. BMC Rheumatol, 2018, 2: 25[2019-05-06]. https://doi.org/10.1186/s41927-018-0032-9.
[14] AVINA-ZUBIETA J A, CHOI H K, SADATSAFAVI M, et al. Risk of cardiovascular mortality in patients with rheumatoid arthritis: a meta-analysis of observational studies. Arthritis Rheum,2008,59(12): 1690–1697. DOI: 10.1002/art.24092
[15] SOLOMON D H, KREMER J, CURTIS J R, et al. Explaining the cardiovascular risk associated with rheumatoid arthritis: traditional risk factors versus markers of rheumatoid arthritis severity. Ann Rheum Dis,2010,69(11): 1920–1925. DOI: 10.1136/ard.2009.122226
[16] 汪汉, 蔡琳. 心功能与类风湿关节炎. 心血管病学进展,2013,34(5): 690–694. DOI: 10.3969/j.issn.1004-3934.2013.05.027 [17] THIMMULAPPA R K, LEE H, RANGASAMY T, et a1. Nrf2 is a critical regulator of the innate immune response and survival during experimental sepsi. J Clin Invest,2006,116(4): 984–995. DOI: 10.1172/JCI25790
[18] LIANG N, KITTS D D. Amelioration of oxidative stress in Caco-2 cells treated with pro-inflammatory proteins by chlorogenic acid isomers via activation of the Nrf2-Keap1-ARE-Signaling pathway. J Agric Food Chem,2018,66(42): 11008–11017. DOI: 10.1021/acs.jafc.8b03983
[19] YAZICI D, TOKAV S, AVDIN S, et al. Echocardiographic evaluation of cardiac diastolic function in patients with rheumatci d arthritis: 5 years of follow-up. Clin Rheumatol,2008,27: 647–650. DOI: 10.1007/s10067-007-0820-x
[20] 万磊, 刘健, 黄传兵, 等. 雷公藤甲素调节佐剂关节炎大鼠滑膜、脾脏、胸腺组织细胞自噬的实验研究. 四川大学学报(医学版),2017,48(4): 520–525. [21] 张逸风, 苏平, 胡添源, 等. 雷公藤贝壳杉烯酸氧化酶基因的全长cDNA克隆与表达分析. 中国中药杂志,2017,42(1): 88–93. [22] YU H, SHI L, ZHAO S, et al. Triptolide attenuates myocardial ischemia/reperfusion injuries in rats by inducing the activation of Nrf2/HO-1 defense pathway. Cardiovasc Toxicol,2016,16(4): 325–335. DOI: 10.1007/s12012-015-9342-y
[23] 斯金平, 黄文华, 郭宝林, 等. 雷公藤药材中雷公藤甲素变异规律. 中国中药杂志,2006,31(24): 2026–2030. DOI: 10.3321/j.issn:1001-5302.2006.24.002 [24] HOU Z, CHEN L, FANG P, et al. Mechanisms of triptolide-induced hepatotoxicity and protective effect of combined use of isoliquiritigenin: possible roles of Nrf2 and hepatic transporters.Front Pharmacol, 2018, 9: 226[2019-05-06]. https://doi.org/10.3389/fphar.2018.00226.
[25] 丁怡, 赵庆亮, 李勇刚, 等. 雷公藤甲素对血管内皮细胞迁移活性的作用. 四川大学学报(医学版),2005,36(3): 347–350. [26] YAND Y Q, YAN X T, WANG K, et al. Triptriolid e alleviates lipopolysaccharide-induced liver injury by Nrf2 and NF-κB signaling pathways.Front Pharmacol, 2018, 9: 999[2019-05-06]. https:/doi.org/10.3389/fphar.2018.00999.
[27] WU B K, YUAN R Y, CHANG Y P, et al. Epicatechin isolated from Tripterygium wilfordii extract reduces tau-GFP-induced neurotoxicity in zebrafish embryo through the activation of Nrf2. Biochem Biophys Res Commun,2016,477(2): 283–289. DOI: 10.1016/j.bbrc.2016.06.058
-
期刊类型引用(2)
1. 李世杰,张诗雨,孙阳,高攀,崔琳,谢世阳,高原,王幼平. 雷公藤甲素对ox-LDL诱发的血管内皮细胞炎症反应的抑制作用及机制研究. 世界科学技术-中医药现代化. 2023(04): 1341-1349 .  百度学术
百度学术
2. 李旭艳. 雷公藤多苷片治疗老年类风湿关节炎的临床效果. 内蒙古中医药. 2021(06): 23-24 .  百度学术
百度学术
其他类型引用(1)

 首页
首页


 下载:
下载: