Effects of Histone Methyltransferase Inhibitors on the Survival, Apoptosis and Cell Cycle of Raji Cells
-
摘要:目的 研究组蛋白甲基化酶Zeste基因增强子同源物2(enhancer of Zeste homolog 2,EZH2)的3种抑制剂(UNC1999、DZNep及GSK343)对人B细胞非霍奇金淋巴瘤Raji细胞的影响。方法 PCR扩增EZH2基因16(Y641)和18(A677)外显子,Sanger测序检测其突变情况;蛋白质免疫印迹法(Western blot)检测正常成年人淋巴细胞及Raji细胞EZH2的表达;使用不同浓度的UNC1999、DZNep及GSK343处理Raji细胞,CCK-8技术检测Raji细胞的生存情况;流式细胞术检测Raji细胞的凋亡情况和细胞周期变化;Western blot检测药物处理后EZH2及H3K27 me3的表达。结果 Sanger测序显示Raji细胞不携带EZH2基因Y641和A677突变位点。Western blot显示,相比正常成年人淋巴细胞,Raji细胞EZH2蛋白高表达。CCK-8法结果显示UNC1999、DZNep及GSK343对Raji细胞均有抑制生存的作用,DZNep抑制能力最弱。流式细胞术凋亡检测显示UNC1999、DZNep及GSK343促进Raji细胞的凋亡,UNC1999作用强于GSK343与DZNep;3种抑制剂均阻滞Raji细胞于G1/G0期,UNC1999组细胞周期阻滞最显著。Western blot显示UNC1999和GSK343抑制EZH2组蛋白甲基化酶的活性,降低H3K27 me3的表达。结论 EZH2抑制剂可通过降低H3K27 me3的表达抑制Raji细胞生存,促进细胞凋亡,改变细胞周期。UNC1999作用效果优于GSK343及DZNep,且EZH2抑制剂对Raji细胞的作用不依赖于EZH2的突变。Abstract:Objective To determine the effects of three histone methylase inhibitors UNC1999, DZNep and GSK343 on the survival, apoptosis and cell cycle of non-hodgkin's lymphoma Raji cells.Methods PCR amplified 16 and 18 exons of enhancer of zeste homolog 2 (EZH2) gene were detected. The expression of EZH2 in normal adult lymphocytes and Raji cells was detected by Western blot. The Raji cells were treated by UNC1999, DZNep and GSK343, followed by CCK-8 assays analyzing cell survival, flow cytometry detecting cell apoptosis and cell cycle, and Western blot detecting the expressions of EZH2 and H3K27 me3.Results The Sanger sequencing results showed that the Raji cells did not carry Y641 and A677 mutation sites of EZH2. The Western blot results showed high expressions of EZH2 in the Raji cells. The results of CCK-8 showed that UNC1999, DZNep and GSK343 inhibited cell survival, and the weakest effect was from DZNep. The flow cytometric assay showed that UNC1999, DZNep and GSK343 promoted apoptosis of the Raji cells, and the effect of UNC1999 was stronger than that of GSK343 and DZNep. The cell cycle was arrested at phase G1/G0 after treatment of the Raji cells with the three inhibitors, with UNC1999 triggering the most significant changes. The Western blot showed that UNC1999 and GSK343 inhibited the histone methylase activity of EZH2 and significantly reduced the expression of H3K27 me3.Conclusion EZH2 inhibitors can inhibit cell survival, promote cell apoptosis and arrest cell cycle at phase G1/G0 of Raji cells through reducing the expression of H3K27me3. UNC1999 has a stronger effect than GSK343 and DZNep.
-
Keywords:
- Raji lymphoma cells /
- EZH2 inhibitors /
- Cell apoptosis /
- Cell cycle
-
淋巴瘤是一种常见的血液系统恶性肿瘤,起源于淋巴组织或淋巴结,分为霍奇金淋巴瘤(Hodgkin lymphoma,HL)和非霍奇金淋巴瘤(Non-Hodgkin lymphoma,NHL),NHL侵及范围广、预后差、死亡率高,严重危害人类健康。尽管目前标准化疗对NHL具有较好疗效,但不良反应大,复发率高。因此,探索新的治疗方法具有重要意义[1-2]。
近年来,表观遗传学修饰与肿瘤关系的报道越来越多,组蛋白的甲基化和乙酰化与肿瘤密切相关[3]。Zeste基因增强子同源物2 (enhancer of zeste homolog 2,EZH2)是一种组蛋白甲基化酶,是肿瘤发生、生长及转移中的关键表观调控因子[4]。EZH2在进化上高度保守,是H3K27甲基化的催化酶,调控基因的表达。研究表明,EZH2抑制剂对多种肿瘤都具有治疗效果,是肿瘤治疗的新靶点[5-7]。基因组测序研究证实在淋巴瘤中存在EZH2基因的突变[8-10],Y641F/N/S/H/C和A677G突变位点是功能获得性(gain-of-function)突变,可以加强EZH2的甲基化酶活性,H3K27 me3表达上调,与淋巴瘤发生相关[10-11]。本研究通过细胞生存、细胞凋亡、细胞周期、EZH2及H3K27 me3表达的检测,研究3种EZH2抑制剂UNC1999、DZNep及GSK343对Raji细胞的影响。
1. 材料和方法
1.1 材料
1.1.1 细胞株
人B细胞非霍奇金淋巴瘤Raji细胞株购自上海赛百慷生物技术股份有限公司。
1.1.2 主要试剂及仪器
抑制剂UNC1999、DZNep及GSK343购于美国Selleck公司;PCR反应试剂购于北京天根生化科技有限公司;洛斯维帕克纪念研究所(RPMI)-1640培养基、胰蛋白酶及胎牛血清购于美国Gibco公司;人外周血淋巴细胞分离液购于北京索来宝科技有限公司;CCK-8试剂盒、磷脂结合蛋白Ⅴ-异硫氰酸荧光素(Annexin Ⅴ-FITC)试剂盒及细胞周期检测试剂盒购于日本同仁化学所;蛋白裂解液及二奎啉甲酸法(BCA)试剂盒购于上海碧云天生物技术有限公司;EZH2 (#3147)、H3K27 me3 (#9733)及Histone H3 (#4499)购于美国Cell Signaling Technology;β-actin (#ab62761)购于美国Abcam公司;近红外荧光二抗山羊抗兔(92632211)、山羊抗小鼠(9263210)购于LI-COR Biosciences公司。酶标仪及二氧化碳培养箱购于美国Thermo Fisher公司;FACS Canto流式细胞仪购于美国BD公司;近红外双色荧光成像系统Odyssey CLx购于美国LI-COR Biosciences公司。
1.2 方法
1.2.1 Raji细胞培养
Raji细胞为悬浮细胞,圆形,成簇生长,当细胞复苏且密度达到80%左右时进行传代,在37 ℃、体积分数5% CO2条件下进行培养,扩大培养后,取第6代细胞用于下述实验。
1.2.2 PCR检测Raji细胞EZH2基因Y641和A677突变热点
收集Raji细胞,加入核酸裂解液裂解细胞,DNA提取试剂盒提取DNA,对EZH2 16(Y641)和18(A677)外显子进行PCR扩增,扩增引物如下:exon 16 正向 5′-TAGTCTACTTTGTCCCCAGTC-3′,exon 16 反向 5′-GAATACAGGTTATCAGTGCCTT-3′,exon 18 正向 5′-ACTGAAATTATTCACTGGGCT-3′,exon 18 反向 5′-CATCATCACAGGACTGAAAAG-3′。反应条件为94 ℃预变性2 min;94 ℃ 10 s,52 ℃ 30 s,72 ℃ 30 s,40个循环;72 ℃延伸5 min。PCR产物测序后与Genbank中的EZH2正常序列进行比较。
1.2.3 Western blot检测正常人淋巴细胞和Raji细胞EZH2蛋白的表达
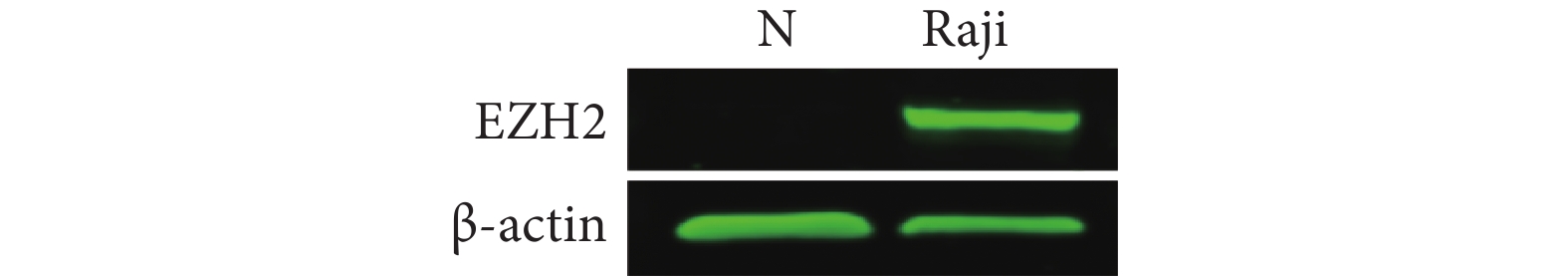
招募志愿者,抽取正常成年人血液2 mL(已获知情同意),按照人外周血淋巴细胞分离液试剂盒的方法分离正常淋巴细胞,分别用蛋白裂解液提取正常淋巴细胞和Raji细胞总蛋白,BCA试剂盒测定蛋白质浓度,聚丙烯酰胺凝胶电泳后转印至PVDF膜,脱脂牛奶封闭后,分别孵育抗体EZH2(1:250)和内参β-actin(1:1 000),4 ℃过夜。PBS/T洗膜后室温孵育LICOR荧光二抗(1:10 000)40 min,洗膜后使用Odyssey CLx近红外双色荧光成像系统成像,使用Image Studio Ver4.0软件采集图片和进行荧光信号强度值分析。以条带荧光强度与内参荧光强度的比值为目的条带的蛋白相对表达量。
1.2.4 抑制剂UNC1999、DZNep及GSK343的配制
抑制剂UNC1999相对分子质量为569.74,抑制剂DZNep相对分子质量为298.73,抑制剂GSK343的相对分子质量为541.69,分别配制成1 μmol/L母液,再用培养基稀释为50、25、15、5、2.5及1.0 μmol/L。
1.2.5 CCK-8法检测3种抑制剂对Raji细胞生存的影响
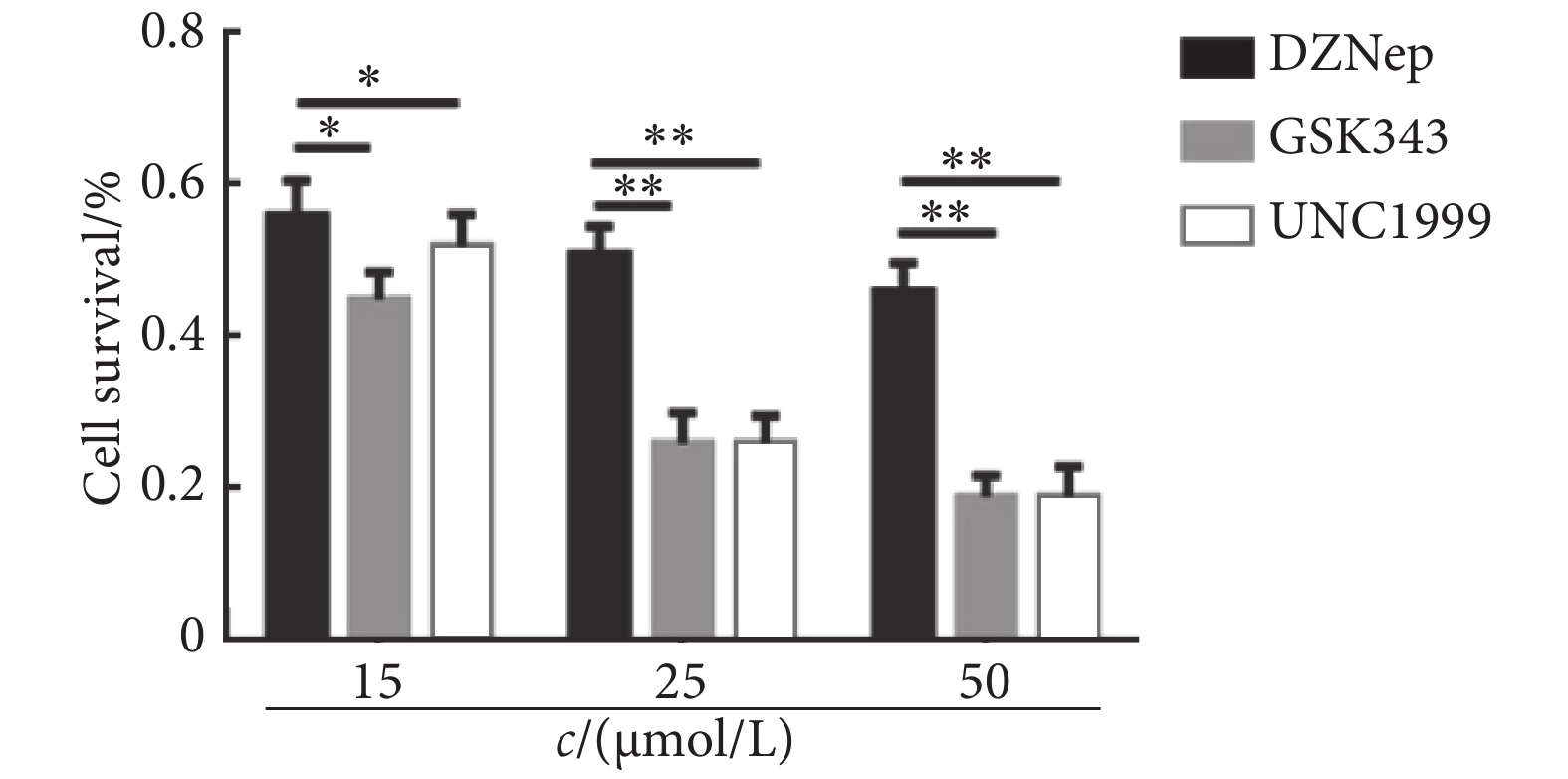
Raji细胞以1×104/孔接种于96孔板。第2天,用上述浓度的3种抑制剂分别处理Raji细胞48 h,并设对照组(Raji细胞,不加药物),每组设6个复孔,设无细胞孔为质控孔。加入CCK-8溶液,使用酶标仪测定450 nm处的吸光度,计算细胞生存率[(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%],并计算3种药物对Raji细胞作用的半数抑制浓度(IC50)。倒置显微镜下观察处理48 h后Raji细胞的生长形态。根据各抑制剂的细胞生存曲线的IC50,使用UNC1999 15 μmol/L、DZNep 25 μmol/L及GSK343 15 μmol/L进行后继实验。
1.2.6 流式细胞术检测3种抑制剂对Raji细胞凋亡的影响
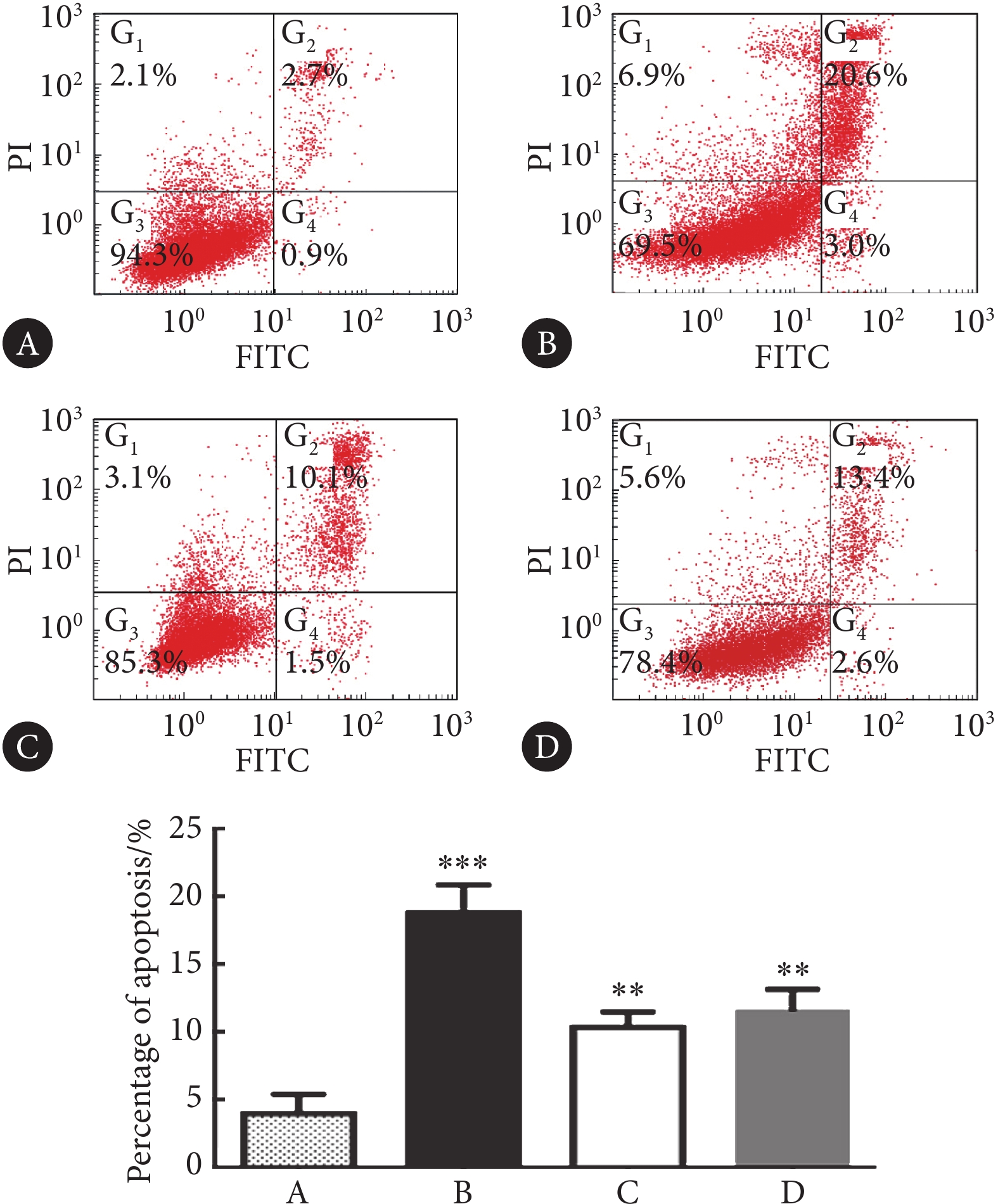
Raji细胞以1×105/孔接种于12孔板,分别使用3种抑制剂处理Raji细胞,并设对照组(Raji细胞,不加药物),48 h后根据凋亡试剂盒说明书进行Annexin Ⅴ-FITC/碘化丙啶(PI)染色,通过流式细胞术检测细胞凋亡,计算凋亡率。
1.2.7 流式细胞术检测3种抑制剂对Raji细胞周期的影响
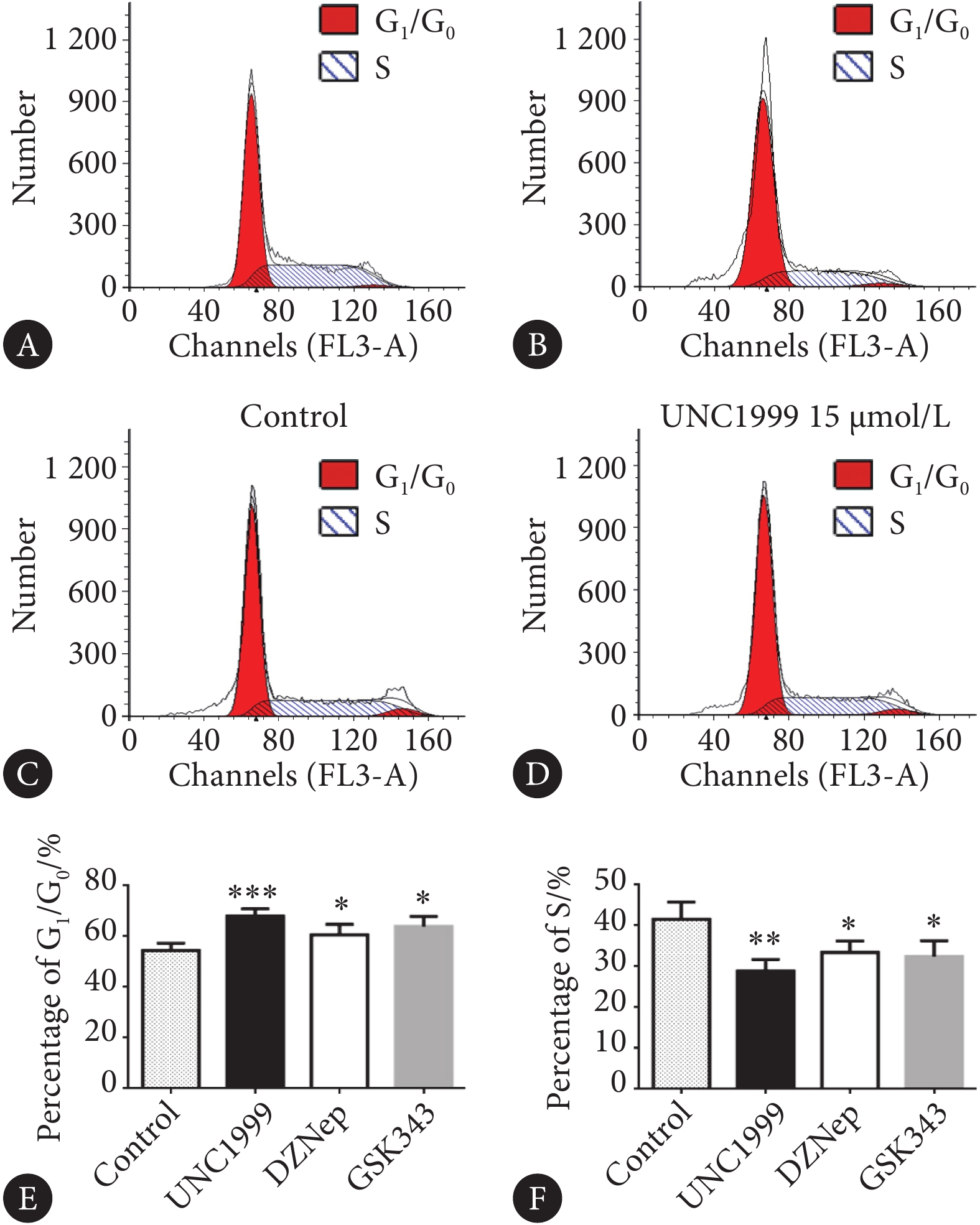
Raji细胞以1×106/孔接种于6孔板,分别加入3种抑制剂处理Raji细胞,并设对照组(Raji细胞,不加药物),48 h后根据细胞周期检测试剂盒说明书进行PI/RNase染色,通过流式细胞术检测细胞周期。使用MODIFIT软件进行结果分析,计算G1/G0期和S期的百分比。
1.2.8 Western blot检测3种抑制剂处理后Raji细胞EZH2和H3K27 me3的表达
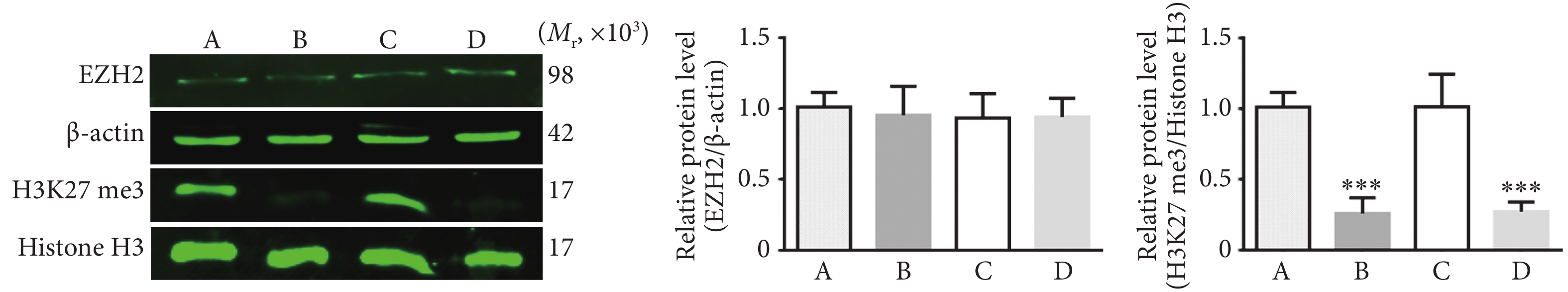
Raji细胞以1×106/孔接种于6孔板,第2天分别加入3种抑制剂对Raji细胞进行处理,并设对照组(Raji细胞,不加药物),培养48 h后收集细胞,进行Western blot检测,方法见1.2.3。一抗为EZH2(1:250)及内参β-actin(1:1 000),H3K27 me3 (1:1 000)及内参Histone H3(1:1 000)。以条带荧光强度与内参荧光强度的比值为目的条带的蛋白相对表达量。
1.2.9 统计学方法
实验重复3次。多组间比较采用单因素方差分析,两组间比较采用t检验,P<0.05差异有统计学意义。
2. 结果
2.1 Raji细胞EZH2基因Y641和A677突变热点比对结果
测序结果与EZH2正常序列对比,未发现Raji细胞携带EZH2基因Y641和A677突变位点。
2.2 Raji细胞和正常人淋巴细胞中EZH2蛋白的表达
Western blot结果显示,人正常淋巴细胞EZH2表达极弱,而Raji细胞高表达EZH2。将正常淋巴细胞组EZH2表达设为1.0,Raji细胞组EZH2蛋白表达较其升高(1.0 vs. 102.4,P<0.01)(图1)。
2.3 3种EZH2抑制剂对Raji细胞生存的抑制
CCK-8结果显示,以对照组的细胞生存率为1,与对照组相比,5 μmol/L UNC1999和GSK343,2.5 μmol/L的DZNep开始抑制Raji细胞的生存,随着药物浓度的增加抑制作用增强。在1、2.5及5 μmol/L浓度下,3种抑制剂对Raji细胞的作用差异无统计学意义,在15、25和50 μmol/L浓度下(图2),UNC1999和GSK343对Raji细胞生存的抑制作用强于DZNep,差异有统计学意义(P<0.05)。3种药物以IC50值UNC1999 (15 μmol/L)、DZNep( 25 μmol/L)及GSK343 (15 μmol/L)处理Raji细胞48 h后,对细胞生存都有抑制作用(图3)。
2.4 3种EZH2抑制剂对Raji细胞凋亡的影响
相对于对照组,UNC1999、DZNep及GSK343都可诱导Raji细胞凋亡,差异有统计学意义(P<0.01),其中UNC1999诱导Raji细胞凋亡最强(图4)。
2.5 3种EZH2抑制剂对Raji细胞周期影响
相对于对照组,UNC1999、DZNep及GSK343处理细胞后,G1/G0期增加,S期减少(P均<0.05),表明DNA合成速度减慢,细胞停滞在G1/G0期,差异有统计学意义,其中UNC1999组对细胞周期阻滞最为显著(图5)。
2.6 EZH2及H3K27 me3的蛋白质表达检测
3种EZH2抑制剂处理Raji细胞48 h后,EZH2蛋白质表达没有变化,UNC1999和GSK343组H3K27me3的表达下降,与对照组相比,差异有统计学意义(P<0.001)(图6)。
3. 讨论
EZH2定位于人染色体7q35,可以使核小体组蛋白H3赖氨酸27位点甲基化,从而沉默靶基因来参与调节细胞的增殖、分化及肿瘤形成[12-13]。EZH2在多种实体肿瘤中高表达,如黑色素瘤、肾透明细胞癌、乳腺癌、胆管癌、肺癌、肝癌、膀胱癌、结直肠癌等,而在正常组织中低表达或者不表达,并且EZH2的表达与肿瘤的恶性特征、转移及患者的预后有关[14-15]。此外EZH2与血液系统肿瘤密切相关,EZH2存在功能获得性和功能缺失性两种状态,分别发挥原癌基因或者抑癌基因的作用[16]。MORIN等[11]发现EZH2 Y641位点突变在GCB型弥漫大B细胞淋巴瘤(diffuse large B-cell lymphomas,DLBCLs)突变率为22%,在滤泡性淋巴瘤(follicular lymphomas,FLs)突变率为7%。其后证实Y641及A677G突变为功能获得性突变,导致H3K27 me3表达升高进而导致淋巴瘤的形成[8-10]。
BEGUELIN等[17]发现EZH2与源自生发中心B细胞的淋巴瘤相关,不论EZH2是正常或突变,并开发一种新型的高度特异的EZH2抑制剂,与BCL2靶向药物联用有可能获得更强大的协同效应。
EZH2抑制剂治疗淋巴瘤的机制及抑制剂的筛选仍是研究的热点,MCCABE等使用GSK126抑制剂能有效抑制EZH2突变DLBCL细胞系的生存,并能显著抑制EZH2突变DLBCL异种移植小鼠的生长[18]。KNUSTSON等[19]发现EPZ-6438抑制剂对EZH2突变型非霍奇金淋巴瘤具有较强的抗肿瘤活性。BISSERIER等[20]对DLBCL细胞进行研究,发现多种功能获得性突变可使DLBCL对EZH2抑制剂产生耐药性,是通过激活IGF-1R、MEK和PI3K信号实现,对GSK126和EPZ-6438耐药性的DLBCL细胞,对UNC1999和EED226敏感。以上研究表明,EZH2不同的抑制剂对淋巴瘤的治疗效果不同,需要深入探讨。本研究使用3种EZH2抑制剂对Raji细胞进行研究,实验结果表明UNC1999对Raji细胞生存、凋亡、细胞周期及H3K27 me3表达作用最强,GSK343次之,DZNep效果最弱。UNC1999和GSK343可能结合在EZH2甲基化酶催化结构域(SET domain),抑制EZH2甲基化酶活性,降低H3K27 me3表达,从而影响Raji细胞的生存。通过测序分析,未发现Raji细胞携带EZH2突变热点,说明EZH2抑制剂对Raji细胞的作用不完全依赖于EZH2的突变,EZH2抑制剂对Raji细胞的作用可能是通过降低H3K27 me3表达来实现的。
该实验结果证实了EZH2抑制剂对非霍奇金淋巴瘤的抑制作用,在Raji细胞中,UNC1999作用最强,说明不同的抑制剂对不同淋巴瘤的作用不同。提示在临床中使用EZH2抑制剂进行淋巴瘤治疗前,需要进行EZH2突变检测及明确细胞类型,选择合适的抑制剂,才能达到精准治疗的目的。本研究为B细胞非霍奇金淋巴瘤的治疗提供了理论依据,但具体作用机制尚不完全清楚,需要进一步研究。
-
-
[1] HERFARTH K, KONIG L. Radiation therapy (4 Gy vs. 24 Gy) in patients with indolent non-Hodgkins lymphoma: Results of the FORT Study. Strahlenther Onkol,2014,190(11): 1084–1085. DOI: 10.1007/s00066-014-0728-8
[2] ROBERSON P, WILDERMAN S, AVRAM A, et al. Biological-effect modeling of radioimmunotherapy for non-hodgkins lymphoma: determination of model parameters. Cancer Biother Radiopharm,2014,29(1): 26–33. DOI: 10.1089/cbr.2012.1467
[3] TRNENY M, SALKOVA J, DLOUHA J, et al. Hepatic involvement in patients with non-Hodgkins lymphoma. Vnitr Lek,2013,59(7): 606–611.
[4] MASUDO K, SUGANUMA N, NAKAYAMA H, et al. EZH2 Overexpression as a useful prognostic marker for aggressive behaviour in thyroid cancer. In Vivo,2018,32(1): 25–31.
[5] CHEN S, YAO F, XIAO Q, et al. EZH2 inhibition sensitizes tamoxifenresistant breast cancer cells through cell cycle regulation. Mol Med Rep,2018,17(2): 2642–2650.
[6] GAN L, YANG Y, LI Q, et al. Epigenetic regulation of cancer progression by EZH2: from biological insights to therapeutic potential. Biomark Res,2018(6):10[2019-02-20].https://dx.doi.org/10.1186/s40364-018-0122-2.
[7] LI L. EZH2: novel therapeutic target for human cancer. Biomedicine (Taipei), 2014(4): 1[2019-02-20].https://dx.doi.org/10.7603/s40681-014-0001-6.
[8] SNEERINGER C, SCOTT M, KUNTZ K, et al. Coordinated activities of wild-type plus mutant EZH2 drive tumor-associated hypertrimethylation of lysine 27 on histone H3(H3K27) in human B-cell lymphomas. Proc Natl Acad Sci U S A,2010,107(49): 20980–20985. DOI: 10.1073/pnas.1012525107
[9] YAP D, CHU J, BERG T, et al. Somatic mutations at EZH2 Y641 act dominantly through a mechanism of selectively altered PRC2 catalytic activity, to increase H3K27 trimethylation. Blood,2011,117(8): 2451–2459. DOI: 10.1182/blood-2010-11-321208
[10] MCCABE M, GRAVES A, GANJI G, et al. Mutation of A677 in histone methyltransferase EZH2 in human B-cell lymphoma promotes hypertrimethylation of histone H3 on lysine 27(H3K27). Proc Natl Acad Sci U S A,2012,109(8): 2989–2994. DOI: 10.1073/pnas.1116418109
[11] MORIN R, JOHNSON N, SEVERSON T, et al. Somatic mutations altering EZH2(Tyr641) in follicular and diffuse large B-cell lymphomas of germinal-center origin. Nat Genet,2010,42(2): 181–185. DOI: 10.1038/ng.518
[12] KIM K, ROBERTS C. Targeting EZH2 in cancer. Nat Med,2016,22(2): 128–134. DOI: 10.1038/nm.4036
[13] YAMAGISHI M, UCHIMARU K. Targeting EZH2 in cancer therapy. Curr Opin Oncol,2017,29(5): 375–381. DOI: 10.1097/CCO.0000000000000390
[14] YAN K, LIN C, LIAO T, et al. EZH2 in cancer progression and potential application in cancer therapy: a friend or foe? Int J Mol Sci,2017,18(6):pii:E1172[2019-02-20]. https://dx.doi.org/ 10.3390/ijms18061172.
[15] SIMON J, LANGE C. Roles of the EZH2 histone methyltransferase in cancer epigenetics. Mutat Res,2008,647(1/2): 21–29.
[16] 张秀灵. EZH2基因与恶性肿瘤侵袭和转移关系的研究进展. 国际输血及血液学杂志,2014,37(2): 163–167. DOI: 10.3760/cma.j.issn.1673-419X.2014.02.017 [17] BEGUELIN W, POPOVIC R, TEATER M, et al. EZH2 is required for germinal center formation and somatic EZH2 mutations promote lymphoid transformation. Cancer Cell,2013,23(5): 677–692. DOI: 10.1016/j.ccr.2013.04.011
[18] MCCABE MT, OTT HM, GANJI G, et al. EZH2 inhibition as a therapeutic strategy for lymphoma with EZH2-activating mutations. Nature,2012,492(7427): 108–112. DOI: 10.1038/nature11606
[19] KNUTSON SK, KAWANO S, MINOSHIMA Y, et al. Selective inhibition of EZH2 by EPZ-6438 leads to potent antitumor activity in EZH2-mutant non-Hodgkin lymphoma. Mol Cancer Ther,2014,13(4): 842–854. DOI: 10.1158/1535-7163.MCT-13-0773
[20] BISSERIER M, WAJAPEYEE N. Mechanisms of resistance to EZH2 inhibitors in diffuse large B-cell lymphomas. Blood,2018,131(19): 2125–2137. DOI: 10.1182/blood-2017-08-804344

 首页
首页


 下载:
下载: