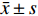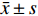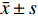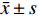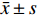-
摘要:目的 合成3种芦荟大黄素金属配合物,并比较配体和配合物的抗氧化活性。方法 在无水乙醇溶剂中,通过溶解、搅拌合成芦荟大黄素-铁(Ⅱ)、芦荟大黄素-铜(Ⅱ)、芦荟大黄素-镁(Ⅱ)3种配合物,并对其结构进行表征,采用Fe2+-H2O2-亚甲蓝法、二苯代苦味肼基自由基法(DPPH法)等检测配体和配合物对超氧自由基(O2-•)、羟基自由基(•OH)、二苯代苦味肼基自由基(DPPH•)的清除作用。结果 成功合成芦荟大黄素-铁(Ⅱ)、芦荟大黄素-铜(Ⅱ)、芦荟大黄素-镁(Ⅱ)3种配合物,根据结构表征结果,推测芦荟大黄素金属配合物可能结构为两分子芦荟大黄素通过9位羰基和8位羟基与一分子金属离子(Fe2+、Mg2+、Cu2+)形成配合物。配合物和配体对3种自由基均有清除作用,但配合物的清除作用强于其配体(P<0.05)。结论 芦荟大黄素与Fe2+、Cu2+、Mg2+ 3种金属离子配位后,增强了其配体本身的抗氧化活性。Abstract:Objective To synthesize three kinds of metal complexes of aloe-emodin and compare the antioxidant activities of the ligands and the complexes.Methods Three kinds of aloe emodin metal complex, the aloe-emodin-iron (Ⅱ), the aloe-emodin-copper (Ⅱ) and the aloe-emodin-magnesium (Ⅱ) complexes, were synthesized by dissolving and stirring in anhydrous ethanol solvent, and their structures were characterized. The Fe2+-H2O2-methylene blue method, the diphenyl bitter hydrazine radical method (DPPH method) and other assays were used to determine the clearance effect of ligands and complexes on superoxide radicals (O2-•), hydroxyl radicals (•OH) and phenyl bitter hydrazine radical (DPPH•).Results Three kinds of aloe emodin metal complex, the aloe-emodin-iron (Ⅱ), the aloe-emodin-copper (Ⅱ) and the aloe-emodin-magnesium (Ⅱ) complexes, were successfully synthesized. According to the results of structural characterization, we speculated that the aloe-emodin metal complexes were formed at the site between the two molecules of aloe-emodin and one molecule of metal ions (Fe2+, Mg2+, Cu2+) via the 9th carbonyl and 8th hydroxyl groups of the aloe-emodin molecules. Both the complex and the ligand have clearance effects on three kinds of free radicals, and the complex showed stronger effects than its ligand (P<0.05).Conclusion Coordination of aloe-emodin with metal ions, such as Fe2+, Cu2+, and Mg2+, could enhance the antioxidant activity of the ligand itself.
-
Keywords:
- Aloe-emodin /
- Metal complex /
- Synthesis /
- Antioxidant
-
芦荟大黄素属于蒽醌类衍生物,是从大黄、芦荟中提取的一种生物活性成分,其化学名称为1,8-二羟基-3-羟甲基蒽醌[1]。芦荟大黄素生物化学及药理作用具有多样性,研究发现其有强烈的抗菌[2]、抗氧化[3]、抗肿瘤[4]等活性。近年来研究发现,中药活性成分与金属离子配位通常能够增强或改变其配体本身的活性[5-13]。原花青素与Fe3+配位后,其抗氧化活性增强[7];染料木素与Zn2+配位后,其抗肿瘤活性增强[14];大黄酸与Fe3+等金属离子配位后,其抗菌活性增强[15]。芦荟大黄素的9位羰基和1,8位羟基能与金属离子配位[16]。本实验选择Fe2+、Cu2+、Mg2+等金属离子与配体芦荟大黄素配位,合成芦荟大黄素金属配合物,研究其可能的配位结构,并比较配体和配合物的抗氧化活性,筛选出抗氧化活性最高的配合物。
1. 材料与方法
1.1 仪器和试剂
傅立叶变换中红外光谱仪(Tensor);AM-400型超导核磁共振仪(BRUKER公司);TDZ5-WS型多管架自动平衡离心机(湖南湘仪实验室仪器开发有限公司);UV-1700型紫外分光光度计(上海美仪仪器有限公司);EXSTAR 6000型热分析仪(上海斯迈欧分析仪器有限公司);DF-101S型集热式恒温磁力搅拌器(巩义市予华仪器有限责任公司);BP211D型电子分析天平(德国Sartorius公司);UPH-Ⅱ-10T型优普超纯水制造系统(成都超纯科技有限公司);U型96孔板(成都胜拓仪器有限公司)。
氯化硝基四氮唑蓝(NBT)、二苯代苦味肼基自由基(DPPH•)、羟甲基氨基甲烷(tris)、还原性辅酶Ⅰ二钠盐(NADHNa2)、N-甲基吩嗪甲基硫酸盐(PMS)(Sigma公司);无水甲醇、无水乙醇、氨水、氯化铜、硫酸亚铁、醋酸镁、DMSO均为市售分析纯;芦荟大黄素粉末(成都康邦生物生物科技有限公司,纯度大于98.5%)。
1.2 配合物的合成
1.2.1 芦荟大黄素-铜(Ⅱ)和芦荟大黄素-铁(Ⅱ)配合物的合成
在250 mL圆底烧瓶中加入270 mg芦荟大黄素(1 mmol),再加入60 mL无水乙醇,于60 ℃下加热搅拌溶解,配体溶解后将含85.24 mg CuCl2•2H2O(0.5 mmol)的15 mL无水乙醇溶液滴加到配体黄色澄清溶液中,用氨水的乙醇溶液(体积比1∶1)调节黄色澄清溶液的pH值至10左右,反应液有紫黑色沉淀生成,控制反应温度60 ℃,搅拌反应12 h,反应液静置过夜后进行抽滤,将所得到的沉淀依次用无水乙醇和乙醚离心洗涤至溶液无色澄清透明,产物在40 ℃下真空干燥72 h,得到紫黑色粉末状固体产物,即为芦荟大黄素-铜(Ⅱ)配合物。用FeSO4•7H2O(硫酸亚铁)作为金属盐,以同样方法合成棕褐色粉末状芦荟大黄素-铁(Ⅱ)配合物。
1.2.2 芦荟大黄素-镁(Ⅱ)配合物的合成
在250 mL圆底烧瓶中加入270 mg芦荟大黄素(1 mmol),再加入60 mL无水乙醇,于60 ℃下加热搅拌溶解,配体溶解后将含有107.23 mg C4H6O4Mg•4H2O(0.5 mmol)的15 mL无水乙醇滴加到配体黄色澄清溶液中,用氨水的乙醇溶液(体积比1∶1)调节黄色澄清溶液的pH 值至10左右,反应液变成紫红色,控制反应温度60 ℃,搅拌反应12 h,无沉淀生成,反应液过滤将所得透明澄清滤液装在西林瓶中于室温下缓慢挥发3周左右析出紫红色晶体。
1.3 配合物的表征
1.3.1 紫外光谱
将芦荟大黄素和芦荟大黄素金属配合物配成浓度为5.0×10−5 mol/L的无水甲醇溶液,在200~600 nm 范围内进行UV-vis 扫描,分别获得吸收光谱。
1.3.2 红外光谱
将1~2 mg芦荟大黄素和芦荟大黄素金属配合物与适量的溴化钾研细均匀,置于模具中,用油压机压成透明薄片,扫描获得红外吸收光谱。
1.3.3 核磁共振
以氘代二甲基亚砜(DMSO-d6)为溶剂测定芦荟大黄素和芦荟大黄素金属配合物的核磁共振氢谱。
1.3.4 热重-差热分析
在氮气气流30 mL/min下以 10 ℃/min速率从25 ℃升温至900 ℃,对芦荟大黄素金属配合物进行热重-差热分析。
1.3.5 滴定
1.3.5.1 芦荟大黄素-铜(Ⅱ)和芦荟大黄素-铁(Ⅱ)配合物的滴定
分别称取60 mg芦荟大黄素-铜(Ⅱ)和芦荟大黄素-铁(Ⅱ)配合物,放置在马弗炉中于800 ℃下灼烧至恒重得到基准金属氧化物粉末。用少量稀硫酸溶解样品,加碘化钾(KI)固体2 g、水50 mL。用硫代硫酸钠溶液滴定至终点时,加3 mL淀粉指示剂显蓝色,用硫代硫酸钠溶液继续滴加至溶液由蓝色变为无色时停止,记下硫代硫酸钠溶液消耗的体积数。平行测定3次,并做空白对照(不加基准金属氧化物粉末,其他照常)。
配合物中金属离子含量:Mi%=(CN×VN×M)÷(m×1 000)×100%,其中,Mi表示Cu2+或Fe2+,m表示配合物质量,CN
表示滴定液浓度,M表示金属离子相对分子质量,VN表示滴定液体积。 1.3.5.2 芦荟大黄素-镁(Ⅱ)配合物的滴定
称取60 mg芦荟大黄素-镁(Ⅱ)配合物放置在马弗炉中于800 ℃下灼烧至恒重得到基准氧化镁粉末。用少量稀盐酸溶解样品,加50 mL水、2~4滴铬黑T指示剂、10 mL氨-氯化铵缓冲溶液。用EDTA溶液滴定至样品溶液由紫红色变为蓝色,并记下EDTA溶液消耗的体积数。平行测定3次,并做空白对照(不加基准氧化镁粉末,其他照常)。
配合物中Mg2+含量:Mi%=(CN×VN)÷(m×25)×100%,其中,Mi表示Mg2+,m表示配合物质量,CN表示滴定液浓度,VN表示滴定液体积。
1.4 抗氧化实验
1.4.1 样品溶液的配制
分别以蒸馏水和无水甲醇作溶剂,将芦荟大黄素和金属配合物配制成质量浓度为0.156、0.312、0.625、1.25、2.5 mg/L的溶液,备用。
1.4.2 配体及配合物对O2-•自由基的清除作用
采用碱性条件下邻苯三酚的自氧化产生O2-•自由基体系[17]。本实验对其略作修改,反应体系为pH值为8的4 mL Tris-HCl缓冲溶液(0.05 mol/L),其中含有1 mL样品溶液、0.1 μmol NBT、0.04 μmol PMS、0.2 μmol NADHNa2。反应体系在室温下放置5 min后,其样品在波长386 nm处测定吸光度值(A样),同时做空白对照(A0,用1 mL蒸馏水代替样品溶液)。重复实验3次,取A样平均值。
1.4.3 配体及配合物对DPPH•自由基的清除作用[18]
反应体系是在5 mL的容量瓶中加入3 mL DPPH无水甲醇溶液(8 mg/L)和1 mL样品溶液,再用无水甲醇定容,摇匀。反应体系在暗室下反应30 min后,其样品在波长518 nm 处测定A样值,同时做空白对照(A0,1 mL无水甲醇替代样品溶液)。重复实验3次,取A样平均值。
1.4.4 配体及配合物对•OH自由基的清除作用
采用Fe2+-H2O2-亚甲蓝体系[19],反应体系是在5 mL容量瓶中加入1 mL pH值为8的Tris-HCl缓冲溶液(0.05 mol/L)、0.5 mL过氧化氢溶液(0.5%)、0.5 mL硫酸亚铁溶液(2 mmol/L)、1.5 mL亚甲蓝溶液(0.02 g/L)和1 mL样品溶液,并用蒸馏水定容,摇匀。将反应体系放置在水浴锅中加热40 min后,其样品在波长664 nm处测定A样值,同时做空白对照(A0,1 mL蒸馏水替代样品溶液)。重复实验3次,取A样平均值。
以上3种自由基清除率的计算公式为:清除率=(A0−A样)/A0×100%。
1.5 统计学方法
实验数据以
$ \bar x \pm s$ 表示。多组间比较采用单因素方差分析,组间两两比较采用t检验,P<0.05为差异有统计学意义。2. 结果
2.1 配合物的一般性质
配合物与配体相比较,外观、颜色及性质都发生了明显的变化。芦荟大黄素-镁(Ⅱ)配合物呈紫红色,芦荟大黄素-铜(Ⅱ)配合物呈紫黑色,芦荟大黄素-铁(Ⅱ)配合物呈棕褐色。金属配合物的熔点升高,在800 ℃高温下灼烧至恒重可以得到基准金属氧化物粉末。3种金属配合物均易溶于二甲基甲酰胺(DMF)、二甲基亚砜(DMSO),微溶于甲醇、乙醇,难溶于水、丙酮、乙醚、三氯甲烷等试剂。
2.2 紫外光谱
在200~600 nm范围内对5.0×10-5 mol/L芦荟大黄素和金属配合物的无水甲醇溶液进行UV-vis扫描得到吸收光谱,见表1。芦荟大黄素在225 nm、255 nm处的吸收峰是由苯样结构引起,285 nm处的吸收峰是由醌样结构引起,429 nm处的吸收峰是由醌样结构中的C=O引起。芦荟大黄素-镁(Ⅱ)配合物和芦荟大黄素-铜(Ⅱ)配合物在520 nm左右均出现一个新的弱小吸收峰。
表 1 芦荟大黄素及其金属配合物的UV主要数据Table 1. Main UV data of aloe emodin and its metal complexesCompound λmax (log ξ) Aloe-emodin 225 nm (2.260), 255 nm (1.216), 285 nm (0.767), 429 nm (0.464) Aloe-emodin-iron (Ⅱ) 226 nm (2.357), 259 nm (1.196), 290 nm (0.744), 431 nm (0.482) Aloe-emodin-copper (Ⅱ) 229 nm (2.108), 263 nm (1.662), 289 nm (0.802), 453 nm (0.782), 529 nm (0.853) Aloe-emodin-magnesium (Ⅱ) 228 nm (2.276), 262 nm (1.396), 286 nm (0.617), 433 nm (0.417), 515 nm (0.284) 2.3 红外光谱
芦荟大黄素和金属配合物的红外光谱主要特征峰见表2。芦荟大黄素及其金属配合物在3 299~3 500 cm−1处均有宽而强的羟基特征伸缩振动峰,在1 200~1 300 cm−1区域均有酚羟基的C-O键伸缩振动峰,表明配体和配合物中均有酚羟基存在,但配合物的羟基吸收峰相比于配体发生了小幅度的红移,表明酚羟基参与了配位成键。配合物的羰基吸收峰相比于配体发生了小幅度的蓝移,可能是配合物中配位作用使C=O键减弱,电子云密度减少,表明羰基氧参与了配位成键。分子中C=C的振动频率也发生了不同程度的变化,可能由于羰基和羟基发生螯合后发生了相应的变化。同时配合物在低频区500 cm−1左右均出现了一个新的弱吸收峰,表明氧原子与金属离子(Fe2+、Mg2+、Cu2+)配位形成了M-O键。
表 2 芦荟大黄素及其金属配合物的红外光谱主要数据Table 2. Main data of infrared spectra of aloe-emodin and its metal complexesCompound ν (O-H)/cm−1 ν (C=O)/cm−1 ν (C=C)/cm−1 ν (C-O)/cm−1 ν (M-O)/cm−1 Aloe-emodin 3 408 1 675 1 571 1 2741 285 1 628 1 455 Aloe-emodin-Iron (Ⅱ) 3 385 1 627 1 455 1 287 537 3 299 1 272 Aloe-emodin-copper (Ⅱ) 3 407 1 620, 1 594 1 517, 1 490 1 201, 1 277 514 Aloe-emodin-magnesium (Ⅱ) 3 420 1 673, 1 627 1 572, 1 457 1 275, 1 287 455 2.4 核磁共振氢谱
芦荟大黄素及其金属配合物的核磁共振氢谱见表3。芦荟大黄素1H NMR 中δ11.93(1H,S) 和δ11.86(1H,S)为2个酚羟基的活泼氢信号;δ7.24(1H,s),δ7.35(1H,d),δ7.76(1H,s),δ7.65(1H,d),δ7.75(1H,t)为蒽醌母核的5个芳香氢信号;δ5.60(1H,s)为羟甲基中羟基的氢信号,δ4.60(2H,d)为羟甲基中甲基的氢信号。金属配合物相比于芦荟大黄素,其核磁共振氢谱发生了明显的变化,配合物中的氢谱多出现重峰,其氢的个数加倍。
表 3 芦荟大黄素及其金属配合物的1H NMR的数据(DMSO-d6)Table 3. 1H NMR data of aloe-emodin and its metal complex (DMSO-d6)Compound Chemical shift (δ) Aloe-emodin Aloe-emodin-Iron (Ⅱ)
11.93 (1H, S, OH), 11.86 (1H, S, OH), 7.24 (1H, s), 7.35 (1H, d), 7.76 (1H, s), 7.65 (1H, d), 7.75 (1H, t), 5.60 (1H, s, −CH2OH), 4.60 (2H, d, -CH2), 7.09-7.72 (10H, m), 5.31−5.61 (2H, m, −CH2OH), 4.49−4.67 (4H, m, −CH2) Aloe-emodin-copper (Ⅱ) 6.98−7.81 (10H, m), 5.21−5.61 (2H, m, −CH2OH), 4.39−4.62 (4H, m, −CH2) Aloe-emodin-magnesium (Ⅱ) 11.80 (2H, S, OH), 6.90−7.81 (10H, m), 5.60 (2H, m, −CH2OH), 4.60 (4H, m, −CH2) 2.5 热重-差热分析
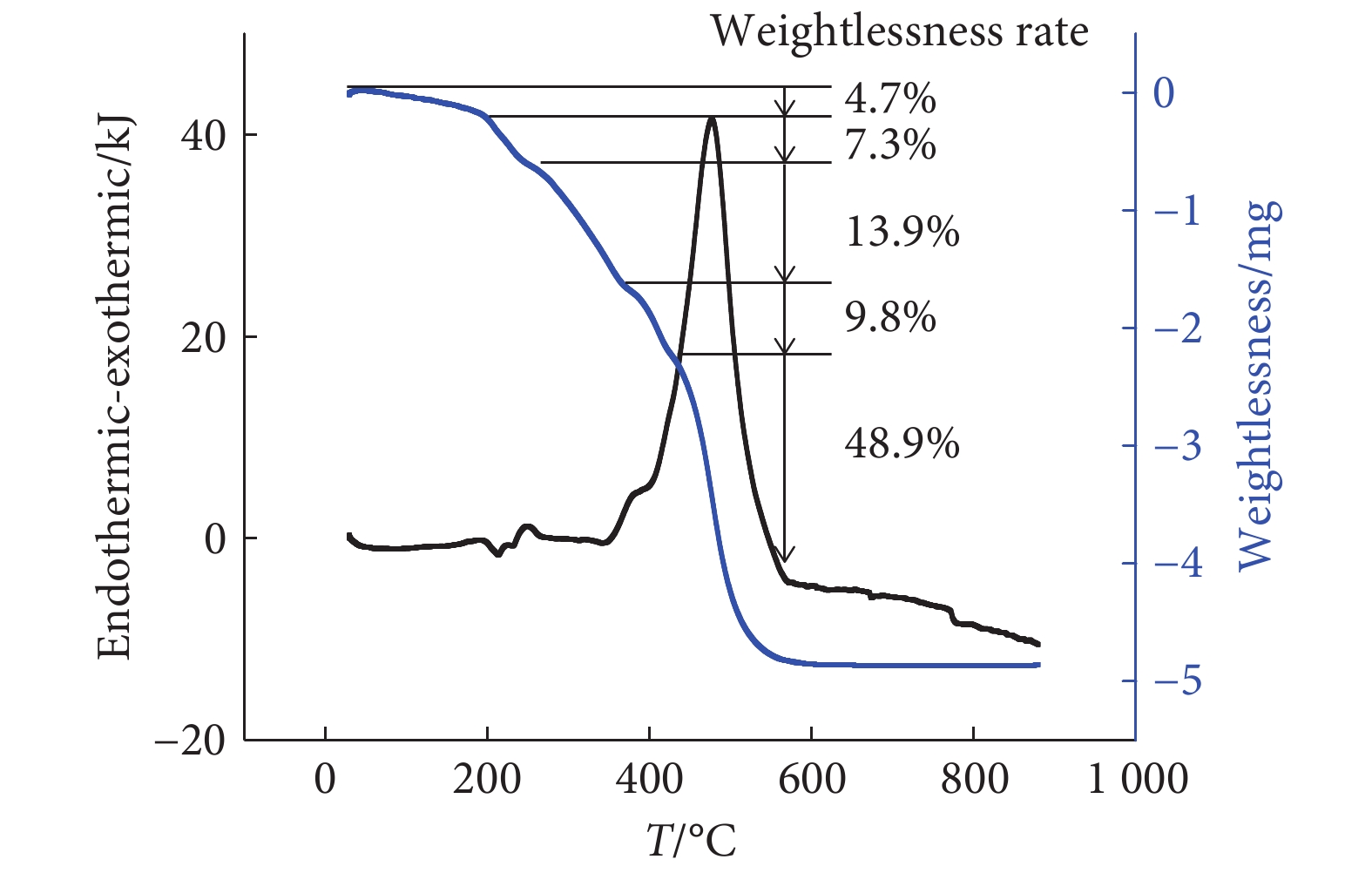
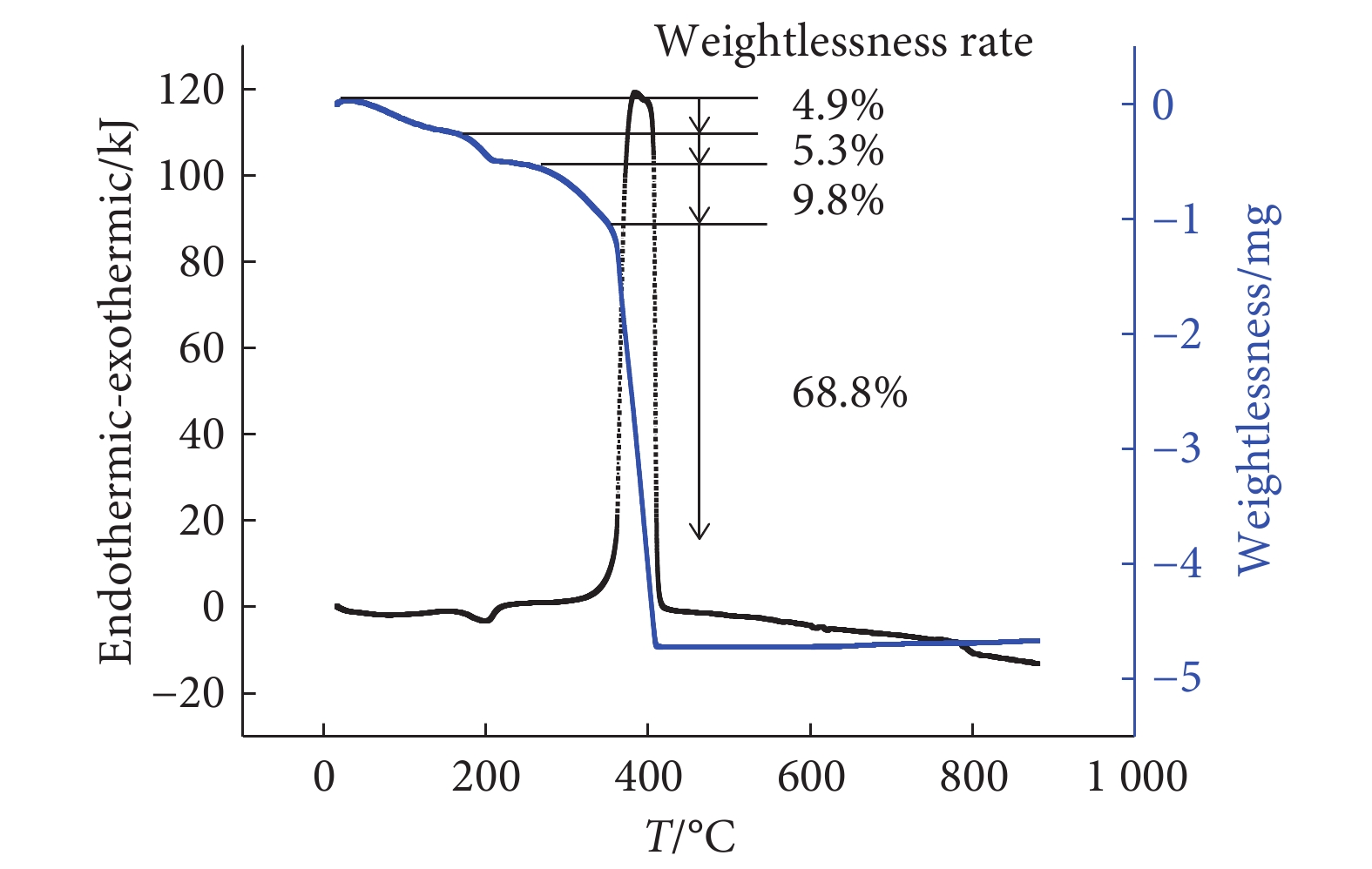
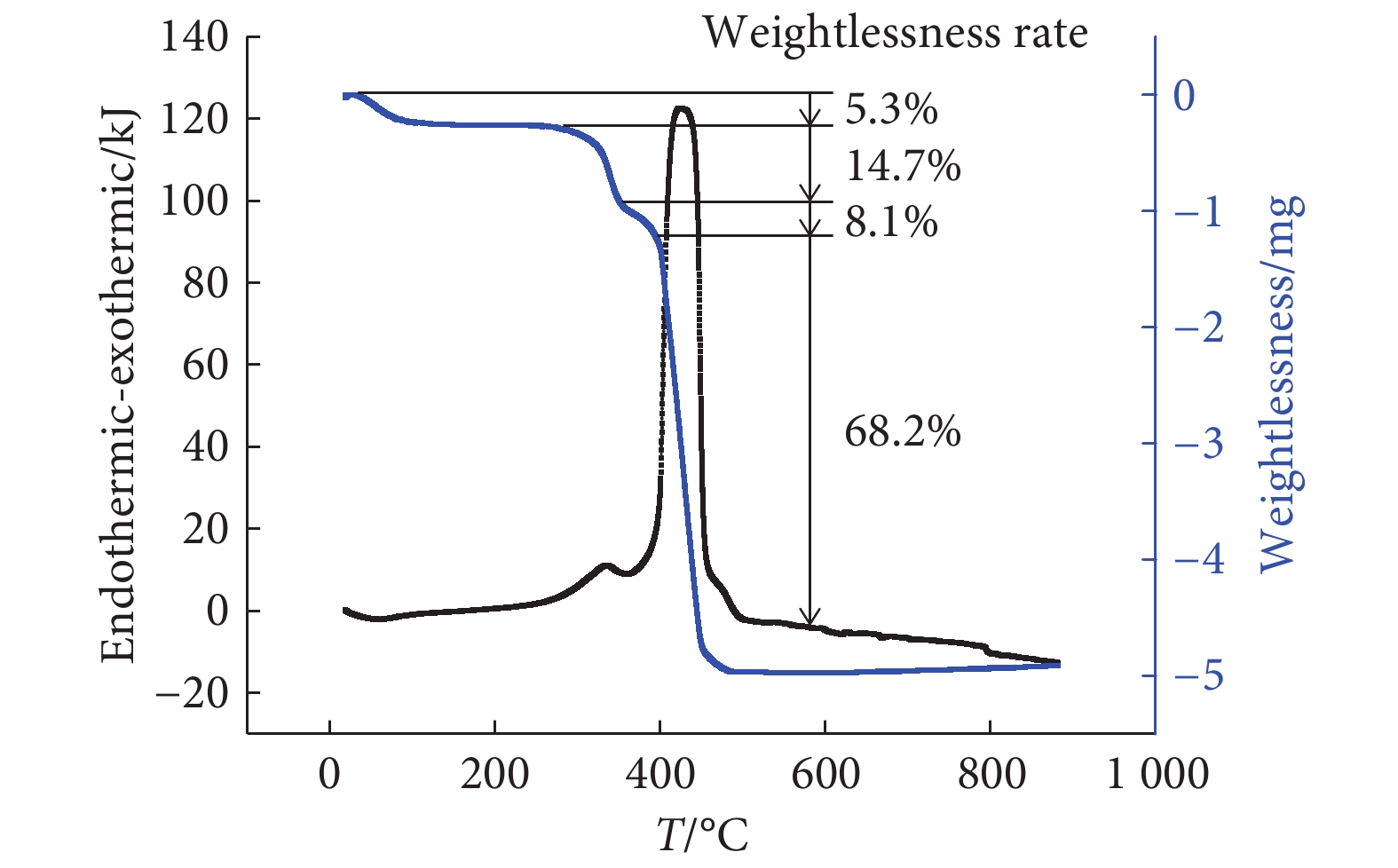
芦荟大黄素-铁(Ⅱ)配合物存在连续的5个失重阶段(图1),芦荟大黄素-铜(Ⅱ)配合物存在连续的4个失重阶段(图2),芦荟大黄素-镁(Ⅱ)存在连续的4个失重阶段(图3)。金属配合物升温到一定程度时达到恒重,剩余产物为金属氧化物粉末。
2.6 配合物滴定结果
由表4可见,配合物中金属元素的实际测试值与理论值基本吻合,配合物滴定的结果符合一分子金属离子(Fe2+、Mg2+、Cu2+)与两分子芦荟大黄素配位。
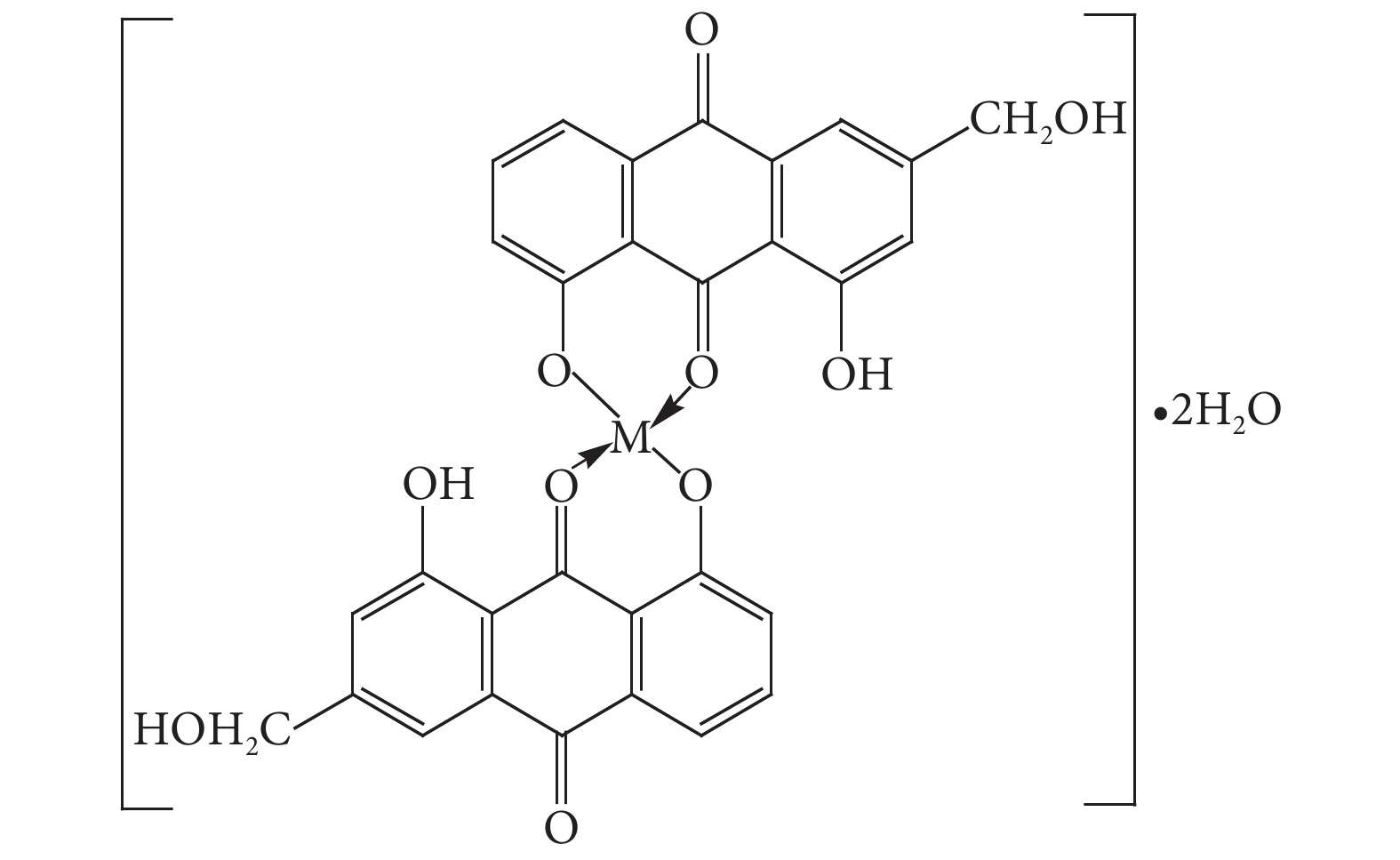
表 4 配合物中金属离子测定结果Table 4. Measurement results of metal ions in the complexComplex Iron element Copper element Magnesium element Measured Theory Measured Theory Measured Theory Aloe-emodin-Iron (Ⅱ) 9.17% 9.37% aloe-emodin-copper (Ⅱ) 10.12% 10.53% Aloe-emodin-magnesium (Ⅱ) 4.21% 4.30% 由以上结构表征结果,推测芦荟大黄素金属配合物的可能结构式:两分子芦荟大黄素通过9位羰基和8位羟基与一分子金属离子 (Fe2+、Mg2+、Cu2+) 形成配合物,见图4。
2.7 抗氧化实验结果
2.7.1 配体及配合物对O2-•自由基的清除
由表5可知,芦荟大黄素及其配合物都有抗O2-•自由基活性,且在一定质量浓度范围内配合物和配体对O2-•自由基的清除率随质量浓度升高而增加,配合物对O2-•自由基清除作用强于其配体芦荟大黄素(P<0.05)。芦荟大黄素和配合物清除O2-•自由基的半数有效浓度(half effective concentration, EC50)值分别为:芦荟大黄素6.03 mg/L,芦荟大黄素-铁(Ⅱ)1.72 mg/L,芦荟大黄素-铜(Ⅱ)0.98 mg/L,芦荟大黄素-镁(Ⅱ)0.95 mg/L。
表 5 芦荟大黄素及其配合物对O2-•自由基的清除率($ \bar x \pm s$ ,n=4)Table 5. Scavenging rates of aloe-emodin and its complexes on O2- • free radicals ($ \bar x \pm s$ , n=4)Group Scavenging rate/% 0.156 mg/L 0.312 mg/L 0.625 mg/L 1.25 mg/L 2.5 mg/L Aloe-emodin 14.2±0.04 19.6±0.05 25.7±0.07 32.6±0.04 39.6±0.02 Aloe-emodin-iron (Ⅱ) 30.2±0.02* 35.6±0.05* 42.5±0.03* 47.4±0.02* 52.7±0.02* Aloe-emodin-copper (Ⅱ) 32.9±0.08* 38.2±0.03* 46.8±0.02* 52.3±0.06* 58.7±0.01* Aloe-emodin-magnesium (Ⅱ) 36.4±0.04* 42.1±0.07* 49.2±0.09* 57.3±0.04* 62.8±0.07* *P<0.05, vs. aloe-emodin group. 2.7.2 配体及配合物对DPPH•自由基的清除
由表6可知,芦荟大黄素及其配合物均具不同程度的抗DPPH•自由基活性,且在一定质量浓度范围内配合物和配体对DPPH•自由基的清除率随质量浓度升高而增加;芦荟大黄素-铁(Ⅱ)的活性均强于配体芦荟大黄素(P<0.05),芦荟大黄素-铜(Ⅱ)的活性在0.312~2.5 mg/L范围内强于配体芦荟大黄素(P<0.05),芦荟大黄素-镁(Ⅱ)的活性在0.625~2.5 mg/L范围内强于配体芦荟大黄素(P<0.05)。
表 6 芦荟大黄素及其配合物对DPPH•自由基的清除率($ \bar x \pm s$ ,n=4)Table 6. Scavenging rates of aloe-emodin and its complexes on DPPH • free radical ($ \bar x \pm s$ , n=4)Group Scavenging rate/% 0.156 mg/L 0.312 mg/L 0.625 mg/L 1.25 mg/L 2.5 mg/L Aloe-emodin 5.9±0.02 10.8±0.03 10.4±0.03 10.8±0.07 19.1±0.05 Aloe-emodin-iron (Ⅱ) 14.1±0.03* 15.6±0.03* 17.2±0.08* 19.6±0.03* 20.6±0.02* Aloe-emodin-copper (Ⅱ) 4.3±0.07 11.9±0.04* 14.8±0.09* 17.3±0.06* 27.9±0.08* Aloe-emodin-magnesium (Ⅱ) 5.8±0.05 8.76±0.03 19.3±0.04* 20.2±0.08* 27.1±0.05* *P<0.05, vs. aloe-emodin group. 2.7.3 配体及配合物对•OH自由基的清除
由表7可知,芦荟大黄素及其配合物都有抗•OH自由基活性,且在一定质量浓度范围内配合物和配体对•OH自由基的清除率随质量浓度升高而增加,配合物的对•OH自由基清除作用强于其配体芦荟大黄素(P<0.05)。芦荟大黄素和配合物清除•OH自由基的EC50值分别为,芦荟大黄素4.88 mg/L,芦荟大黄素-铁(Ⅱ)0.52 mg/L,芦荟大黄素-铜(Ⅱ)0.23 mg/L,芦荟大黄素-镁(Ⅱ)0.77 mg/L。
表 7 芦荟大黄素及其配合物对•OH自由基的清除率($ \bar x \pm s$ ,n=4)Table 7. Scavenging rates of aloe-emodin and its complexes on• OH radical ($ \bar x \pm s$ , n=4)Group Scavenging rate/% 0.156 mg/L 0.312 mg/L 0.625 mg/L 1.25 mg/L 2.5 mg/L Aloe-emodin 37.0±0.01 41.9±0.05 43.8±0.02 44.9±0.02 47.3±0.04 Aloe-emodin-iron (Ⅱ) 44.6±0.06* 51.8±0.01* 58.5±0.07* 67.8±0.03* 73.2±0.06* Aloe-emodin-copper (Ⅱ) 43.6±0.06* 57.5±0.02* 60.5±0.05* 64.1±0.3* 76.0±0.02* Aloe-emodin-magnesium (Ⅱ) 37.7±0.08* 45.3±0.02* 50.1±0.04* 53.2±0.07* 56.7±0.06* *P<0.05, vs. aloe-emodin group. 3. 讨论
本研究以天然芦荟大黄素为配体合成了芦荟大黄素-铁(Ⅱ)、芦荟大黄素-镁(Ⅱ)、芦荟大黄素-铜(Ⅱ)。在紫外吸收光谱中配合物仍有4个主要吸收峰,吸收峰的形状基本保持不变,但吸收峰的位置相对配体发生了一定程度的红移,可能是由于芦荟大黄素中的羰基参与配位,引起蒽醌结构中羰基电子云密度变化。在红外吸收光谱中配合物的羟基和羰基吸收峰相比于配体发生了小幅度的红移或蓝移。芦荟大黄素的1,8位酚羟基化学性质相似,均有与金属离子配位的可能性,但芦荟大黄素的3位羟甲基具有给电子效应,因此蒽醌结构中离羟甲基较远的8位羟基相比于1位羟基化学性质更活泼更容易解离,通常是8位羟基与金属离子配位。由配合物的热重-差热分析结果可知,芦荟大黄素-铁(Ⅱ)、芦荟大黄素-镁(Ⅱ)、芦荟大黄素-铜(Ⅱ)配合物的第一阶段失重率与理论上失去两个水分子相对应,表明3种金属配合物中均含有两个结晶水。在配合物的滴定中金属元素的实验测试值和理论值互相符合。根据以上分析推断出金属配合物可能的配位结构。
配合物对O2-•自由基的清除作用强于其配体芦荟大黄素,且配合物及配体抗O2-•自由基活性顺序为:芦荟大黄素<芦荟大黄素-铁(Ⅱ)<芦荟大黄素-铜(Ⅱ)<芦荟大黄素-镁(Ⅱ),可能是由于配体芦荟大黄素与金属离子(Fe2+、Mg2+、Cu2+)配位后产生了协同作用,增强了其配体本身抗O2-•自由基活性。
芦荟大黄素及配合物对DPPH•自由基总体清除率不高,最高清除率均低于31%,分析可能是DPPH•自由基较易溶解在甲醇、乙醇中,本实验釆用甲醇为溶剂。而配合物和配体在甲醇中可能不容易形成稳定的中间体,故清除率偏低[20]。
配合物的对•OH自由基清除作用强于其配体芦荟大黄素,且配合物及配体抗•OH自由基活性顺序为:芦荟大黄素<芦荟大黄素-镁(Ⅱ)<芦荟大黄素-铁(Ⅱ)<芦荟大黄素-铜(Ⅱ),可能是由于配体芦荟大黄素和金属离子(Fe2+、Mg2+、Cu2+)配位后产生了协同作用,增强了其配体本身抗•OH自由基活性。
本实验以铁、铜、镁等微量元素作为中心原子合成了3种芦荟大黄素金属配合物,采用核磁共振氢谱法、配位滴定法、红外光谱法、热重-差热分析法、紫外光谱法对其结构进行表征,得出其可能的配位结构;采用Fe2+-H2O2-亚甲蓝法和二苯代苦味肼基自由基法(DPPH法)证明了芦荟大黄素及其配合物在一定浓度下对O2-•自由基、•OH自由基、DPPH•自由基都有清除作用,并且配合物的抗氧化活性强于其配体芦荟大黄素,原因为芦荟大黄素与Fe2+、Mg2+、Cu2+等金属离子络合后,增强了其配体本身的抗氧化活性。
-
表 1 芦荟大黄素及其金属配合物的UV主要数据
Table 1 Main UV data of aloe emodin and its metal complexes
Compound λmax (log ξ) Aloe-emodin 225 nm (2.260), 255 nm (1.216), 285 nm (0.767), 429 nm (0.464) Aloe-emodin-iron (Ⅱ) 226 nm (2.357), 259 nm (1.196), 290 nm (0.744), 431 nm (0.482) Aloe-emodin-copper (Ⅱ) 229 nm (2.108), 263 nm (1.662), 289 nm (0.802), 453 nm (0.782), 529 nm (0.853) Aloe-emodin-magnesium (Ⅱ) 228 nm (2.276), 262 nm (1.396), 286 nm (0.617), 433 nm (0.417), 515 nm (0.284) 表 2 芦荟大黄素及其金属配合物的红外光谱主要数据
Table 2 Main data of infrared spectra of aloe-emodin and its metal complexes
Compound ν (O-H)/cm−1 ν (C=O)/cm−1 ν (C=C)/cm−1 ν (C-O)/cm−1 ν (M-O)/cm−1 Aloe-emodin 3 408 1 675 1 571 1 2741 285 1 628 1 455 Aloe-emodin-Iron (Ⅱ) 3 385 1 627 1 455 1 287 537 3 299 1 272 Aloe-emodin-copper (Ⅱ) 3 407 1 620, 1 594 1 517, 1 490 1 201, 1 277 514 Aloe-emodin-magnesium (Ⅱ) 3 420 1 673, 1 627 1 572, 1 457 1 275, 1 287 455 表 3 芦荟大黄素及其金属配合物的1H NMR的数据(DMSO-d6)
Table 3 1H NMR data of aloe-emodin and its metal complex (DMSO-d6)
Compound Chemical shift (δ) Aloe-emodin Aloe-emodin-Iron (Ⅱ)
11.93 (1H, S, OH), 11.86 (1H, S, OH), 7.24 (1H, s), 7.35 (1H, d), 7.76 (1H, s), 7.65 (1H, d), 7.75 (1H, t), 5.60 (1H, s, −CH2OH), 4.60 (2H, d, -CH2), 7.09-7.72 (10H, m), 5.31−5.61 (2H, m, −CH2OH), 4.49−4.67 (4H, m, −CH2) Aloe-emodin-copper (Ⅱ) 6.98−7.81 (10H, m), 5.21−5.61 (2H, m, −CH2OH), 4.39−4.62 (4H, m, −CH2) Aloe-emodin-magnesium (Ⅱ) 11.80 (2H, S, OH), 6.90−7.81 (10H, m), 5.60 (2H, m, −CH2OH), 4.60 (4H, m, −CH2) 表 4 配合物中金属离子测定结果
Table 4 Measurement results of metal ions in the complex
Complex Iron element Copper element Magnesium element Measured Theory Measured Theory Measured Theory Aloe-emodin-Iron (Ⅱ) 9.17% 9.37% aloe-emodin-copper (Ⅱ) 10.12% 10.53% Aloe-emodin-magnesium (Ⅱ) 4.21% 4.30% 表 5 芦荟大黄素及其配合物对O2-•自由基的清除率(
$ \bar x \pm s$ ,n=4)Table 5 Scavenging rates of aloe-emodin and its complexes on O2- • free radicals (
$ \bar x \pm s$ , n=4)Group Scavenging rate/% 0.156 mg/L 0.312 mg/L 0.625 mg/L 1.25 mg/L 2.5 mg/L Aloe-emodin 14.2±0.04 19.6±0.05 25.7±0.07 32.6±0.04 39.6±0.02 Aloe-emodin-iron (Ⅱ) 30.2±0.02* 35.6±0.05* 42.5±0.03* 47.4±0.02* 52.7±0.02* Aloe-emodin-copper (Ⅱ) 32.9±0.08* 38.2±0.03* 46.8±0.02* 52.3±0.06* 58.7±0.01* Aloe-emodin-magnesium (Ⅱ) 36.4±0.04* 42.1±0.07* 49.2±0.09* 57.3±0.04* 62.8±0.07* *P<0.05, vs. aloe-emodin group. 表 6 芦荟大黄素及其配合物对DPPH•自由基的清除率(
$ \bar x \pm s$ ,n=4)Table 6 Scavenging rates of aloe-emodin and its complexes on DPPH • free radical (
$ \bar x \pm s$ , n=4)Group Scavenging rate/% 0.156 mg/L 0.312 mg/L 0.625 mg/L 1.25 mg/L 2.5 mg/L Aloe-emodin 5.9±0.02 10.8±0.03 10.4±0.03 10.8±0.07 19.1±0.05 Aloe-emodin-iron (Ⅱ) 14.1±0.03* 15.6±0.03* 17.2±0.08* 19.6±0.03* 20.6±0.02* Aloe-emodin-copper (Ⅱ) 4.3±0.07 11.9±0.04* 14.8±0.09* 17.3±0.06* 27.9±0.08* Aloe-emodin-magnesium (Ⅱ) 5.8±0.05 8.76±0.03 19.3±0.04* 20.2±0.08* 27.1±0.05* *P<0.05, vs. aloe-emodin group. 表 7 芦荟大黄素及其配合物对•OH自由基的清除率(
$ \bar x \pm s$ ,n=4)Table 7 Scavenging rates of aloe-emodin and its complexes on• OH radical (
$ \bar x \pm s$ , n=4)Group Scavenging rate/% 0.156 mg/L 0.312 mg/L 0.625 mg/L 1.25 mg/L 2.5 mg/L Aloe-emodin 37.0±0.01 41.9±0.05 43.8±0.02 44.9±0.02 47.3±0.04 Aloe-emodin-iron (Ⅱ) 44.6±0.06* 51.8±0.01* 58.5±0.07* 67.8±0.03* 73.2±0.06* Aloe-emodin-copper (Ⅱ) 43.6±0.06* 57.5±0.02* 60.5±0.05* 64.1±0.3* 76.0±0.02* Aloe-emodin-magnesium (Ⅱ) 37.7±0.08* 45.3±0.02* 50.1±0.04* 53.2±0.07* 56.7±0.06* *P<0.05, vs. aloe-emodin group. -
[1] CHEN R, ZHANG J, HU Y, et al. Potential antineoplastic effects of aloe-emodin: a comprehensive review. Am J Chinese Med,2014,42(2): 275–288. DOI: 10.1142/S0192415X14500189
[2] DONG X X, ZENG Y W, LIU Y, et al. Aloe-emodin: a review of its pharmacology, toxicity, and pharmacokinetics. Phytother Res,2020,34(2): 270–281. DOI: 10.1002/ptr.6532
[3] TAO L, XIE J, WANG Y, et al. Protective effects of aloee-modin on scopolamine-induced memory impairment in mice and H2O2-induced cytotoxicity in PC12 cells. Bioorg Med Chem Lett,2014,24(23): 5385–5389. DOI: 10.1016/j.bmcl.2014.10.049
[4] CHEN R, WANG S, ZHANG J, et al. Aloe-emodin loaded solid lipid nanoparticles: formulation design and in vitro anti-cancer study. Drug Deliv,2015,22(5): 666–674. DOI: 10.3109/10717544.2014.882446
[5] 赵明思. 桦木酮酸金属配合物的合成及配位方式研究. 延吉: 延边大学, 2019. [6] 韩慢慢, 李知敏, 陈振华, 等. 中药水煎液中槲皮素-金属配合物的研究. 时珍国医国药,2019,30(4): 876–880. [7] 关亚飞, 陈媛媛, 冯年捷, 等. 原花青素金属配合物合成、表征以及抗氧化性的探究. 中国调味品,2018,43(8): 158–162. DOI: 10.3969/j.issn.1000-9973.2018.08.037 [8] 熊运浩. 基于中药配位化学学说的四种木犀草素金属配合物的合成、结构表征及活性研究. 南昌: 江西科技师范大学, 2018. [9] 张茜. 草乌多糖金属配合物的制备和抗癌活性研究及1,2,4-三氮唑三氮烯类化合物的合成和生物活性研究. 郑州: 郑州大学, 2017. [10] MONDAL P, BOSE A. Spectroscopic overview of quercetin and its Cu (Ⅱ) complex interaction with serum albumins. Bioimpacts,2019,9(2): 115–121. DOI: 10.15171/bi.2019.15
[11] 蔡胜. 木犀草素和金属配合物的制备及其生物活性研究. 广州: 华南理工大学, 2016. [12] ROY S, LOGANATHAN G, DHARUMADURAI D, et al. Model studies on the interactions of a Cu (Ⅱ)-quinone complex with surfactant micelles and DNA explore its induction of apoptosis in human MDA-MB-231 breast adenocarcinoma cells. J Coord Chem,2017,70(12): 2128–2147.
[13] UMADEVI M, MUTHURAJ V, VANAJOTHI R. Synthesis of coumarin derivatives and its Ru (Ⅱ) complexes encompassing pyrazole ring as a potent antidiabetic agents—a biochemical perspective. Inorg Chim Acta,2019,492: 48–59.
[14] 王有娣, 唐旗羚, 徐娟娟, 等. 染料木素-锌配合物的合成及抗癌活性研究. 现代中药研究与实践,2018,32(5): 30–33. [15] 向晖, 潘晓丽, 谭玉柱, 等. 大黄酸金属配合物的抑菌活性研究. 中药与临床,2014,5(4): 19–22. [16] 向晖, 潘晓丽, 熊永爱, 等. 大黄酸金属配合物的结构及对人肝癌HepG2细胞增殖的抑制作用. 中药与临床,2014,5(5): 32–35. [17] 贾红玉, 王亚森, 田晓辉, 等. 邻苯三酚自氧化法在SOD活性测定中的应用. 河北大学学报(自然科学版),2018,38(3): 284–290. [18] 杜凯, 马养民, 郭林新. 杏仁皮单宁提取工艺优化及其DPPH自由基清除活性. 食品工业科技,2019,40(21): 174–178. [19] YANG B, ZHOU P, CHENG X, et al. Simultaneous removal of methylene blue and total dissolved copper in zero-valent iron/H2O2 Fenton system: kinetics, mechanism and degradation pathway. J Colloid Interface Sci,2019,555: 383–393. DOI: 10.1016/j.jcis.2019.07.071
[20] 张建会, 王禹, 张新宇. 大黄素金属配合物的制备与抗氧化性探究. 西部皮革,2017,39(16): 3–6. DOI: 10.3969/j.issn.1671-1602.2017.16.004 -
期刊类型引用(6)
1. 李凯文,王婕,黄子贞,陈晖,谈春霞. 当归多糖锌复合物的自组装形貌及抗氧化活性研究. 化学研究. 2023(06): 496-504 .  百度学术
百度学术
2. 郭茜文,李文斌,张汝学,王荣,赵安鹏,王子晗. 提高2, 3-BPG水平对组织氧气供应的影响及其药物研究进展. 中国医院药学杂志. 2022(04): 450-454 .  百度学术
百度学术
3. 曾怀彬,易明霞,邓爱华,刘亚菲,张婷. 库拉索芦荟大黄素制备工艺研究. 农产品加工. 2022(04): 40-43 .  百度学术
百度学术
4. 丁凯悦,黄嘉彧,霍晓奎,李思琪,张琳,马骁驰,方邦江. 基于液质联用技术研究锦红汤的化学成分及潜在靶点蛋白的预测. 世界科学技术-中医药现代化. 2022(09): 3375-3383 .  百度学术
百度学术
5. 杨常碧,朱艳,唐萍,文晓萍. 芦荟的生物活性研究进展. 山东化工. 2022(24): 73-75 .  百度学术
百度学术
6. 冒海燕,唐俊杰,何雪梅,吴超,吴焕岭,郭庆. pH响应变色生物基聚氨酯的制备及性能. 塑料工业. 2021(12): 29-33 .  百度学术
百度学术
其他类型引用(3)

 首页
首页


 下载:
下载: