Study on the Effect of Polystyrene-Polyvinylpyrrolidone Electrospun Fibre in Inhibiting the Adhesion of Porphyromonas gingivalis
-
摘要:目的 探究聚苯乙烯(PS)及PS-聚乙烯吡咯烷酮(PVP)静电纺丝材料对牙龈卟啉单胞菌黏附能力的影响。方法 采用不锈钢针头及高压电场制备PS及PS-PVP静电纺丝材料;通过扫描电子显微镜观察不同材料表面的牙龈卟啉单胞菌生长黏附状态;通过菌落形成单位(colony forming unit, CFU)测定不同材料表面的牙龈卟啉单胞菌生物膜形成量的变化;通过改变静电纺丝材料表面的电荷性质测定材料表面电荷对牙龈卟啉单胞菌黏附能力的影响。结果 扫描电镜结果显示,PS与PS-PVP均可形成直径0.2 μm的静电纺丝纤维。通过对24 h及48 h的生物膜进行扫描电镜和CFU计数,发现在两种材料表面,牙龈卟啉单胞菌的生物膜黏附量均较少(P<0.05)。在四丁基溴化铵(tetrabutylammonium bromide, TBAB)处理后,PS-PVP静电纺丝材料的表面电荷由负电转为正电,且表面细菌黏附量上升,与未处理的PS及PS-PVP相比差异有统计学意义(P<0.05)。结论 PS及PS-PVP静电纺丝材料可有效降低牙龈卟啉单胞菌的黏附能力,且这种能力可能与材料表面电荷性质相关。Abstract:Objective To explore the effect of polystyrene (PS) and PS-polyvinylpyrrolidone (PVP) electrospun materials on the adhesion ability of Porphyromonas gingivalis (P. gingivalis), a common periodontal pathogen.Methods PS and PS-PVP electrospun materials were prepared with stainless steel needles in high-voltage electric field. The growth and adhesion of P. gingivalis on the surface of different materials were observed with scanning electron microscope (SEM). The changes in the amount of P. gingivalis biofilm formed on the surface of different materials were measured according to viable colony forming units (CFU). The effect of surface charge of the different materials on the adhesion ability of P. gingivalis was determined through changing the charge properties on the surface of the electrospun materials.Results SEM images showed that both PS and PS-PVP can be used to form electrospun fibers with a diameter of 0.2 μm. SEM images and CFU counts of the biofilm at 24 h and 48 h showed that there was a smaller amount of P. gingivalis biofilm on the surface of the two materials (P<0.05). After treatment with tetrabutylammonium bromide (TBAB), the surface charge of the PS-PVP electrospun material changed from being negatively charged to being positively charged, and the amount of bacterial adhesion on the surface increased significantly in comparison to that of untreated PS and PS-PVP materials (P<0.05).Conclusion PS and PS-PVP electrospun materials can be used to reduce the adhesion ability of P. gingivalis on the surface of different materials, and this ability may be related to the surface charge properties of the materials.
-
Keywords:
- Porphyromonas gingivalis /
- Adhesion /
- Electrospun material /
- Surface potential
-
牙周病是一种发生在牙周组织中的疾病,是导致成年人失牙的主要原因之一,也对糖尿病等全身系统性疾病有着加重的作用[1]。我国第四次口腔流行病学调查显示,35岁以上成年人牙龈出血检出率在80%以上,牙石检出率高于90%,中老年人群牙周健康和口腔卫生状况较差[2]。牙龈卟啉单胞菌是成人牙周病的主要致病菌之一。以牙龈卟啉单胞菌为代表的牙周致病菌可形成生物膜来保护细菌,并增强细菌的毒力[3]。目前针对牙菌斑生物膜的主要应对手段是通过机械手段清理,牙菌斑生物膜一旦形成,稳定的结构决定了其难以清除的特点[4],因此,在牙菌斑生物膜形成早期,阻止细菌的黏附是感染性疾病预防的重点[5]。
引导性骨再生技术(guided bone regeneration, GBR)被广泛应用于牙周外科手术及种植术前准备中,GBR屏障膜是实现骨再生技术的关键。为预防手术感染导致的骨再生失败,GBR膜常通过搭载抗生素的方式进行改性[6],但抗生素的大量应用常导致细菌耐药性增强,且部分抗生素对于骨生长有影响,因此,开发新型GBR膜意义重大。静电纺丝材料是一种亚微米材料,既往研究通过改变材料性质或加载药物等方式,使其在以金黄色葡萄球菌为主的感染性疾病致病菌的防控领域有着较为广泛的应用[7-8],但静电纺丝材料对口腔细菌形成的生物膜是否具有抑制效果目前还不清楚。聚苯乙烯(polystyrene, PS)50多年来,一直作为研究贴壁动物细胞和人类细胞的基础材料,拥有优秀的可成形性,是静电纺丝技术的良好材料。本研究中选用PS作为基础静电纺丝材料,可拥有良好的生物安全性和制备简易、成形度高的优势[9]。聚乙烯吡咯烷酮(polyvinylpyrrolidone, PVP),也称聚维酮,是由单体N-乙烯基吡咯烷酮自由基聚合得到的合成聚合物。PVP无毒、无极性、惰性、耐高温、pH、稳定、生物相容性良好[10],并且选择性的对亲水性和疏水性药物均显示出良好的亲和力。鉴于此,本研究中选用PVP与PS混纺进行静电纺丝,可改善PS材料本身的亲水性与药物亲和性。课题组在前期研究中发现PS及PS-PVP静电纺丝材料具有抑制口腔微生物(如变异链球菌)黏附的能力[11]。本实验拟探究牙龈卟啉单胞菌在PS及PS-PVP静电纺丝材料表面的黏附能力,并初步探索其可能的抗黏附机制,为进一步研究静电纺丝材料在抑制牙周致病菌黏附中的应用提供理论依据。
1. 材料与方法
1.1 菌种、设备和仪器
牙龈卟啉单胞菌(ATCC 33277)、PS(相对分子质量280 000)、N,N-二甲基甲酰胺(dimethylformamide, DMF)、氢氧化钠(NaOH)、PVP、Hemin和维生素K均购自Sigma-Aldrich(美国密苏里州圣路易斯);牛脑心浸出液〔brain-heart infusion (BHI), BD〕;SYTO 9、Propidium Iodide(Life Technologies);扫描电子显微镜(FEI,美国),激光共聚焦显微镜(Leica TCS SP2,德国);静电纺丝机(EL系列,Glass Coverslipman High Voltage Inc.,德国)。
1.2 PS及PS-PVP静电纺丝材料制备
室温下将质量分数为20% PS(实验组1)及20% PS和质量分数为0.3% PVP(实验组2)分别溶解在DMF中24 h充分搅拌,制备电纺溶液。将两种溶液装入带有不锈钢针头的注射器(d=0.7 mm)中,通过施加14 kV的高压电场进行静电纺丝,针尖和收集器之间的距离保持在10 cm。使用安装在收集器上的铝箔收集PS及PS-PVP静电纺丝材料约2 h。通过注射泵将溶液流速控制在0.38 mL/h。材料制备的环境温度和相对湿度分别保持在24 ℃和54%。最终,获得PS及PS-PVP电纺纤维膜,并将其切成直径为1 cm的圆片。通过扫描电子显微镜观察其结构并测量其平均直径。
1.3 牙龈卟啉单胞菌培养
将牙龈卟啉单胞菌(ATCC 33277)接种于BHI培养基中,加入Hemin(0.5 mg/mL)及维生素K(10 mg/mL)[12](brain-heart infusion medium supplemented with hemin and menadione, BHIHM),37 ℃,10% CO2、10% H2和80% N2(均为体积分数)环境培养48 h,酶标仪测量菌液浓度,加入BHIHM培养基将菌液稀释至108 CFU/mL。
1.4 生物膜的培养及黏附情况
将复苏的牙龈卟啉单胞菌菌液加入分别含羟基磷灰石片(hydroxyapatite, HA)(阳性对照)、PS静电纺丝材料、PS-PVP静电纺丝材料的12孔板中,每孔预先加入了 1.9 mL含1%蔗糖的BHIHM培养基(BHIHMS),达到最终每孔2 mL稀释菌液,37 ℃,10% CO2、10% H2和80% N2(均为体积分数)环境培养24 h及48 h,并分别采样。
将生物膜培养后的材料转移至无菌12孔板中,使用无菌PBS轻柔漂洗两次,以去除浮游细菌,每孔加入1 mL 2.5%戊二醛溶液,固定过夜,然后将样本在梯度乙醇(体积分数分别为50%,60%,70%,80%,90%,95%,100%)中依次脱水,冷冻干燥机干燥,喷金后在扫描电子显微镜下观察[13]。
1.5 不同材料表面的活菌菌落形成单位(colony forming unit , CFU)计数
用细胞刮刀将培养了24 h及48 h的不同材料表面的生物膜样本轻轻刮下,离心收菌并用BHI培养基稀释,形成菌悬液。然后将悬浮液等比例连续稀释并接种于BHI血琼脂平板上,37 ℃,10% CO2、10% H2和80% N2(均为体积分数)培养5 d后计数CFU。
1.6 不同电位静电纺丝材料的抗生物膜能力测定
将PS溶液、PS-PVP溶液、加入了四丁基溴化铵(tetrabutylammonium bromide, TBAB)的PS-PVP溶液分别用DMF稀释,通过Zeta电位仪(Malvern Zetasizer Nano ZS90,英国Malvern Instruments Ltd.)表征其Zeta电位[10]。
分别将PS、PS-PVP、含TBAB的PS-PVP溶液制备对应材料的静电纺丝(同1.2),无菌环境下将提前复苏的牙龈卟啉单胞菌1∶10稀释,培养至OD600=0.6后BHIHMS培养生物膜,同时加入3种不同原料的静电纺丝材料培养24 h及48 h生物膜,分别观察其扫描电子显微镜结果并进行菌落计数。
1.7 统计学方法
以上实验均重复3次,每组重复实验均设置至少3组平行对照。组间差异使用单因素方差分析(one-way analysis of variance, one-way ANOVA)进行检验比较,两两差异使用分组t检验比较。P<0.05为差异有统计学意义。
2. 结果
2.1 成功制备稳定的PS及PS-PVP静电纺丝膜
在上述制备条件下,我们获得了稳定的PS及PS-PVP静电纺丝膜,从图1中可见,二者在扫描电子显微镜下形态基本保持一致,均为粗细均一、无规律分布的立体网状结构。不同原料的两种纤维直径较为统一,均为0.2 μm。表明已成功制备出了均匀稳定的PS及PS-PVP静电纺丝纤维膜。
2.2 两种静电纺丝材料表面细菌的黏附情况
图2结果表明,在培养生物膜时,牙龈卟啉单胞菌可正常黏附于HA表面,但PS与PS-PVP表面则几乎无细菌黏附,仅能看到静电纺丝纤维形态,24 h细菌黏附情况与48 h相似。
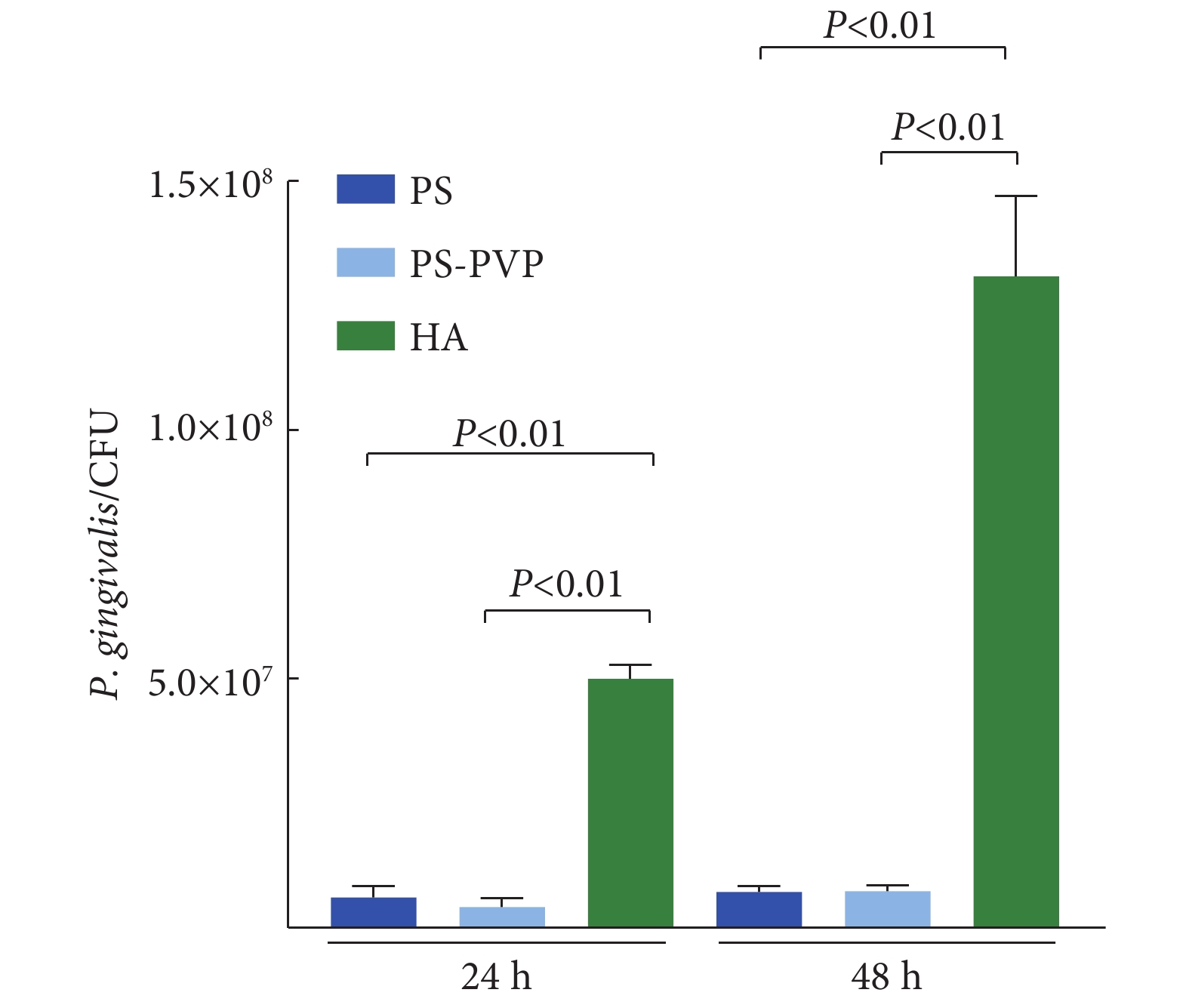
2.3 两种静电纺丝材料表面活菌菌落计数
分别采集24 h与48 h的牙龈卟啉单胞菌生物膜,图3表明,相较于HA表面,PS及PS-PVP两种静电纺丝材料表面均无或较少细菌黏附,且这种抗黏附效果在48 h生物膜中表现更加明显,两种材料间抗黏附效果并无明显差异(P>0.05),其表面的菌落计数均小于阳性对照组HA表面,差异有统计学意义(P<0.01)。
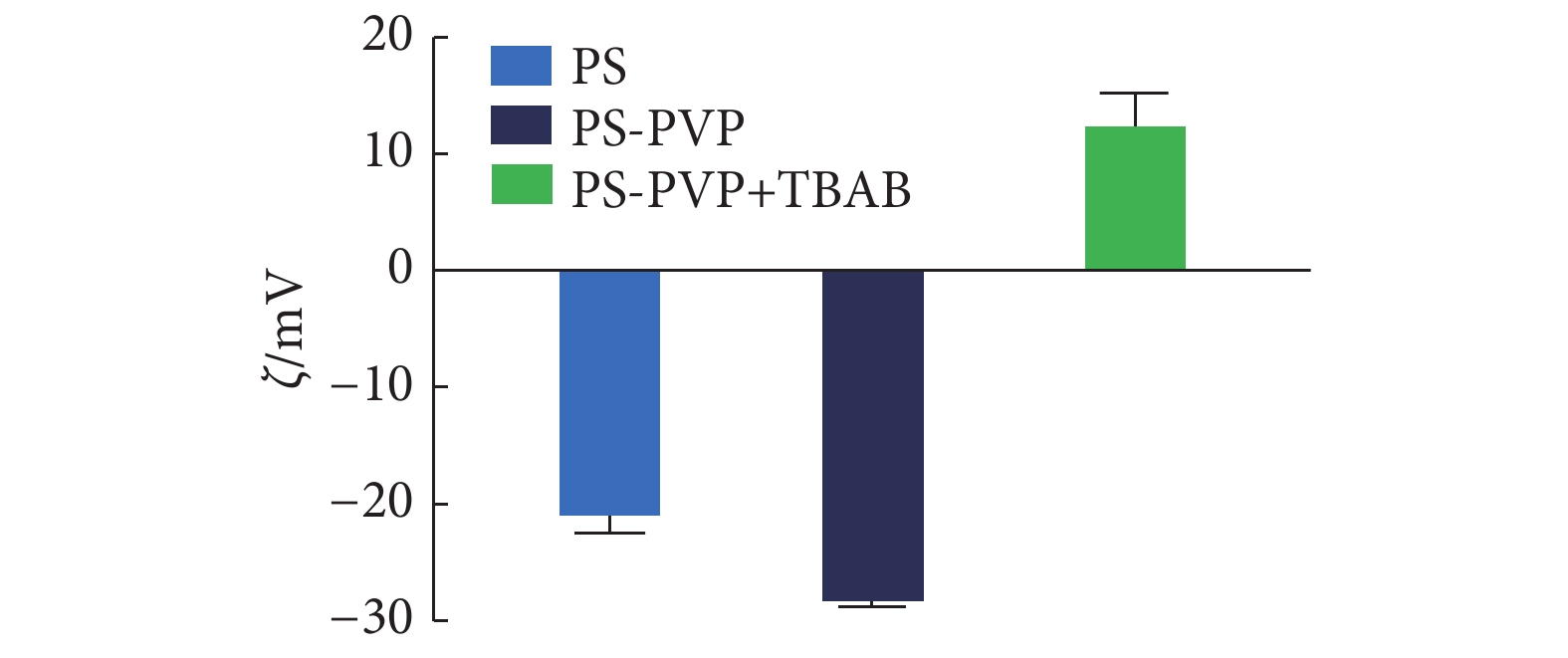
2.4 静电纺丝材料的表面电位对其抗黏附能力的影响
由图4可知,PS与PS-PVP溶液均为负电位,且PS-PVP负电位绝对值更大;在PS-PVP溶液中加入TBAB后,可将溶液转变为正电位。
分别以PS、PS-PVP、PS-PVP+TBAB为原料制备不同表面电位的静电纺丝膜。从图5中可见,对于48 h生物膜,在负电位的PS和PS-PVP材料表面,牙龈卟啉单胞菌的黏附能力较差,但加入TBAB后转变为正电位的PS-PVP材料表面细菌黏附量显著增加。24 h生物膜和48 h生物膜的菌落计数可见,PS-PVP+TBAB组细菌黏附量显著上升,且菌落计数与PS组和PS-PVP组比较差异均有统计学意义(P<0.05),而PS与PS-PVP材料表面细菌黏附量无显著变化。
3. 讨论
牙周炎作为一种破坏牙齿支撑组织的炎症性疾病,是导致成年人失牙的主要原因之一[14]。近期研究发现,牙周致病菌可能与阿尔茨海默症、糖尿病等全身性疾病具有紧密的相关性[15]。因此,针对牙周炎的预防与治疗显得越来越重要。牙龈卟啉单胞菌在成人牙周炎中的检出率最高,且在成人牙周炎患者血清中检出升高的特异性抗体[16],因此被认为是成人牙周炎的主要致病菌。存在于牙菌斑生物膜中的牙龈卟啉单胞菌可通过分泌胶原酶和内毒素引起牙周纤维溶解及机体的炎症反应[17],这对GBR技术中的骨再生影响较大。传统GBR膜要求膜自身不可降解,且应帮助成骨以便于形成新骨,但未对可能引起感染的牙周致病菌有相关应对。在本实验中,静电纺丝材料表现出了抑制牙龈卟啉单胞菌黏附的效果。静电纺丝材料作为一种新型的有机高分子材料,其制备过程中所形成的网状高分子结构,为其提供了高孔隙率、高比表面积的优势,这一特性可促进细胞的生长攀附,因此,静电纺丝材料可具备良好的生物相容性[18],也因此静电纺丝材料在组织工程、体内植入物等方面有着较为广泛的研究与应用[19]。在此基础上,考虑到其良好的生物安全性、不易降解等优点,将静电纺丝材料应用于GBR膜的改良上有着良好的应用前景。
本实验使用了基于PS这种常见有机高分子材料的改良材料。PS本身即具备耐高温、耐腐蚀、无生物毒性等优点。PVP则是一种广泛应用于医学和非医学领域的生物材料,它具备的优秀的理化性质(生物相容性、化学稳定性、在水和多种有机溶剂中具有良好的溶解度、对疏水性物质和亲水性物质均有较好的相容性)[20]使其在静电纺丝材料制备过程中可充当亲水剂的角色,同时为后续其功能的开发提供了大量可能性[21]。既往研究表明[22-23],PS-PVP材料是一种经典、稳定的复合高分子材料。本实验结果显示,PS-PVP表现出了与PS相似的抗牙龈卟啉单胞菌黏附的能力,且与阳性对照组相比较,其表面细菌附着明显减少,这为其在抗牙周致病菌黏附方面的应用提供了可能。TBAB是一种常见的阳离子表面活性剂,尽管部分阳离子表面活性剂在抗变异链球菌等口腔常见微生物方面有着较多的研究[24],但TBAB暂无相关研究报道。从既往研究推测其并无显著的抗菌性能,具体原因或与其烷基结构相关,有待进一步探究。在加入表面活性剂TBAB改变了静电纺丝材料表面电位后,实验结果证实其抗细菌黏附能力受到了一定程度的影响,我们初步猜测材料表面的电荷性质可以影响细菌黏附。牙龈卟啉单胞菌表面带负电荷[25],由于PS与PS-PVP材料自身酰胺基与羧基的影响,静电纺丝材料表面呈现负电位,与细菌表面负电荷相斥,这可能是牙龈卟啉单胞菌无法黏附的原因。
综上所述,本实验探究了PS及PS-PVP静电纺丝材料抗牙龈卟啉单胞菌黏附的能力,同时探究了不同表面电位的静电纺丝材料抗细菌黏附能力的差异,提出了可能由于材料表面与细菌表面电荷相斥导致细菌无法黏附的观点,为材料改性提供了新的思路,也为静电纺丝材料在抑制口腔细菌黏附方面的应用提供了一定理论基础。
* * *
致谢 感谢四川大学化学学院周翠松教授对本课题的技术支持和研究 指导。
利益冲突 所有作者均声明不存在利益冲突
-
-
[1] GRAZIANI F, GENNAI S, SOLINI A, et al. A systematic review and meta-analysis of epidemiologic observational evidence on the effect of periodontitis on diabetes An update of the EFP-AAP review. J Clin Periodontol,2018,45(2): 167–187. DOI: 10.1111/jcpe.12837
[2] 冯希平. 中国居民口腔健康状况——第四次中国口腔健康流行病学调查报告: 2018年中华口腔医学会第十八次口腔预防医学学术年会. 西安, 2018. [3] SAKANAKA A, TAKEUCHI H, KUBONIWA M, et al. Dual lifestyle of Porphyromonas gingivalis in biofilm and gingival cells. Microb Pathog,2016,94: 42–47. DOI: 10.1016/j.micpath.2015.10.003
[4] MARK W J, ROSSETTI B J, RIEKEN C W, et al. Biogeography of a human oral microbiome at the micron scale. Proc Natl Acad Sci U S A,2016,113(6): E791–E800. DOI: 10.1073/pnas.1522149113
[5] ABRANCHES J, ZENG L, KAJFASZ J K, et al. Biology of o
ral Streptococci. Microbiol Spectr,2018,6(5): 10.1128/microbiolspec.GPP3-0042-2018. DOI: 10.1128/microbiolspec.GPP3-0042-2018 [6] MATHEW A, VAQUETTE C, HASHIMI S, et al. Antimicrobial and immunomodulatory surface-functionalized electrospun membranes for bone regeneration. Adv Healthc Mater, 2017, 6(10)[2021-07-15]. https://doi.org/10.1002/adhm.201601345.
[7] ZHAN F, SHENG F, YAN X, et al. Enhancement of antioxidant and antibacterial properties for tannin acid/chitosan/tripolyphosphate nanoparticles filled electrospinning films: Surface modification of sliver nanoparticles. Int J Biol Macromol,2017,104(Pt A): 813–820. DOI: 10.1016/j.ijbiomac.2017.06.114
[8] KAFFASHI B, DAVOODI S, OLIAEI E. Poly(epsilon-caprolactone)/triclosan loaded polylactic acid nanoparticles composite: A long-term antibacterial bionanocomposite with sustained release. Int J Pharm,2016,508(1/2): 10–21. DOI: 10.1016/j.ijpharm.2016.05.009
[9] ZEIGER A S, HINTON B, VAN VLIET K J. Why the dish makes a difference: Quantitative comparison of polystyrene culture surfaces. Acta Biomater,2013,9(7): 7354–7361. DOI: 10.1016/j.actbio.2013.02.035
[10] KURAKULA M, KOTESWARA RAO G S N. Moving polyvinyl pyrrolidone electrospun nanofibers and bioprinted scaffolds toward multidisciplinary biomedical applications. Eur Polym J, 2020, 136: 109919[2021-07-15]. https://doi.org/10.1016/j.eurpolymj.2020.109919.
[11] NIU J, GUO J, DING R, et al. An electrospun fibrous platform for visualizing the critical pH point inducing tooth demineralization. J Mater Chem B,2019,7(27): 4292–4298. DOI: 10.1039/C9TB00392D
[12] TANG Z, LIANG D, CHENG M, et al. Effects of Porphyromonas gingivalis and its underlying mechanisms on Alzheimer-like Tau hyperphosphorylation in Sprague-Dawley rats. J Mol Neurosci,2021,71(1): 89–100. DOI: 10.1007/s12031-020-01629-1
[13] TANG B, GONG T, CUI Y, et al. Characteristics of oral methicillin-resistant Staphylococcus epidermidis isolated from dental plaque. Int J Oral Sci,2020,12(1): 15. DOI: 10.1038/s41368-020-0079-5
[14] BOSTANCI N, BELIBASAKIS G N. Porphyromonas gingivalis: An invasive and evasive opportunistic oral pathogen. FEMS Microbiol Lett,2012,333(1): 1–9. DOI: 10.1111/j.1574-6968.2012.02579.x
[15] SINGHRAO S K, HARDING A, POOLE S, et al. Porphyromonas gingivalis periodontal infection and its putative links with Alzheimer’s disease. Mediators Inflamm, 2015, 2015: 137357[2021-07-15]. https://doi.org/10.1155/2015/137357.
[16] HIRAI K, YAMAGUCHI-TOMIKAWA T, EGUCHI T, et al. Identification and modification of Porphyromonas gingivalis cysteine protease, gingipain, ideal for screening periodontitis. Front Immunol, 2020,11: 1017[2021-09-02]. https://doi.org/10.3389/fimmu.2020.01017.
[17] KUBONIWA M, HOUSER J R, HENDRICKSON E L, et al. Metabolic crosstalk regulates Porphyromonas gingivalis colonization and virulence during oral polymicrobial infection. Nat Microbiol,2017,2(11): 1493–1499. DOI: 10.1038/s41564-017-0021-6
[18] EL-FIQI A, KIM J H, KIM H W. Osteoinductive fibrous scaffolds of biopolymer/mesoporous bioactive glass nanocarriers with excellent bioactivity and long-term delivery of osteogenic drug. ACS Appl Mater Interfaces,2015,7(2): 1140–1152. DOI: 10.1021/am5077759
[19] CHEN X, LIU Y, MIAO L, et al. Controlled release of recombinant human cementum protein 1 from electrospun multiphasic scaffold for cementum regeneration. Int J Nanomedicine,2016,11: 3145–3158. DOI: 10.2147/IJN.S104324
[20] ZHI X, FANG H, BAO C, et al. The immunotoxicity of graphene oxides and the effect of PVP-coating. Biomaterials,2013,34(21): 5254–5261. DOI: 10.1016/j.biomaterials.2013.03.024
[21] TEODORESCU M, BERCEA M. Poly(vinylpyrrolidone)—A versatile polymer for biomedical and beyond medical applications. Polym Plast Technol Eng,2015,54(9): 923–943. DOI: 10.1080/03602559.2014.979506
[22] KHANAL A, NAKASHIMA K. Incorporation and release of cloxacillin sodium in micelles of poly(styrene-b-2-vinyl pyridine-b-ethylene oxide). J Control Release,2005,108(1): 150–160. DOI: 10.1016/j.jconrel.2005.07.018
[23] BASTAKOTI B P, LI Y, GURAGAIN S, et al. Synthesis of mesoporous transition-metal phosphates by polymeric micelle assembly. Chemistry,2016,22(22): 7463–7467. DOI: 10.1002/chem.201600435
[24] LI F, WEIR M D, CHEN J, et al. Effect of charge density of bonding agent containing a new quaternary ammonium methacrylate on antibacterial and bonding properties. Dent Mater,2014,30(4): 433–441. DOI: 10.1016/j.dental.2014.01.002
[25] JUNTER G A, THEBAULT P, LEBRUN L. Polysaccharide-based antibiofilm surfaces. Acta Biomater,2016,30: 13–25. DOI: 10.1016/j.actbio.2015.11.010

 首页
首页



 下载:
下载: